近日,国际期刊杂志《Stem Cell Research & Therapy》发表一篇脂肪干细胞在糖尿病及其并发症治疗中的进展及应用的文献综述,研究表明脂肪干细胞可能成为治疗糖尿病的新方法。脂肪间充质干细胞治疗有可能改善动物和人类的高血糖水平并减轻相关并发症的症状。

糖尿病(DM)是一种严重的慢性代谢性疾病,可导致许多严重的并发症,如心血管疾病、视网膜病变、神经病变和肾脏疾病。一旦确诊患有糖尿病,患者需要服用口服降糖药物或使用胰岛素来控制血糖,减缓病情的进展。这对患者的日常生活产生重大影响,需要持续监测药物的副作用。它还给个人、家庭乃至整个社会带来沉重的经济负担。
脂肪干细胞(ADSC)最近已成为糖尿病及其并发症的新兴治疗方式。脂肪干细胞可以通过多种途径提高胰岛素敏感性,增强胰岛素分泌,从而缓解糖尿病及其并发症。此外,脂肪干细胞还可以促进组织再生、抑制炎症反应、减少组织损伤和细胞凋亡。
间充质干细胞治疗糖尿病及其并发症的潜在机制众多,其广泛的再生和分化能力,以及调节免疫系统和代谢功能的作用,使其成为治疗糖尿病的有力工具。尽管这项技术仍处于早期阶段,但许多研究已经证明了其安全性和有效性,为糖尿病或其并发症患者提供了新的治疗选择。尽管从目前的研究来看,脂肪干细胞在治疗糖尿病的动物实验和临床试验中已经取得了一定的成果,但仍需要进一步的临床试验才能应用于临床。

脂肪间充质干细胞在1型糖尿病中的应用
在T1DM中,由于自身免疫反应,辅助性T细胞1(Th1)攻击胰腺β细胞,导致胰岛素生成细胞(IPC)的损失。巨噬细胞、树突状细胞、自然杀伤细胞和淋巴细胞的存在也会加速T1DM的进展。CD4+T细胞和炎症因子,包括干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)和肿瘤坏死因子-α(TNF-α),在β细胞损伤过程中发挥重要作用。由于胰腺β细胞是体内胰岛素的唯一产生者,它们的死亡导致胰岛素分泌完全消失,最终导致糖尿病的发展。
目前的干预措施无法预防血管变性、肾衰竭和失明等长期并发症。已应用于临床的替代β细胞的方法主要包括全胰腺和胰岛细胞移植。但这些方法的发展仍存在诸多障碍,如缺乏合适的胰岛供体、移植后需要终生免疫抑制治疗、糖尿病患者移植器官和细胞衰竭等,这些都限制了其发展这项技术的研究。
近年来,脂肪干细胞因其自我更新、分化为其他细胞谱系以及调节免疫系统的能力而逐渐受到研究人员的关注。希望能够利用脂肪干细胞的特性来达到治愈1型糖尿病的目标。
动物模型和人体临床试验
在脂肪干细胞应用于动物模型中,未分化的脂肪干细胞或脂肪干细胞分化的IPCs可以通过静脉内、腹腔内或肾囊注射进行移植,如表1所示。研究表明,通过尾静脉给予大量脂肪干细胞,小鼠24小时内死亡率接近85%。减少喷射量可以避免类似的情况发生。一些研究使用腹膜内或肾囊注射来试图避免这个问题。
目前,利用脂肪间充质干细胞治疗1型糖尿病患者仍处于初步研究阶段。该方向相关研究不多,且给药途径存在差异。
目前,已使用的给药途径包括将脂肪干细胞分化为IPC,然后将其注射到门静脉、胸腺或皮下组织中。或者,可以诱导脂肪干细胞成为分泌胰岛素的脂肪干细胞,并与未分级培养的骨髓细胞共同移植到糖尿病患者的门静脉中。它通过门静脉输注给药,因为它可以让细胞停留在肝脏微循环中,而肝脏作为一个耐受器官,不会排斥细胞植入。然而,对于具体的给药方法能够达到更好的治疗效果,目前尚未达成共识。
此外,关于脂肪干细胞移植的数量,目前的研究也存在差异。一些研究使用106个细胞的水平,而另一些研究使用108个细胞的水平,如表2所示。然而,在最大限度地降低脂肪干细胞潜在风险的同时达到治疗效果所需的具体细胞数量仍需要进一步研究。
| 模型 | 来源 | 细胞类型 | 管理/剂量(细胞数)/间隔 | 检测结果 | 改进 |
|---|---|---|---|---|---|
| STZ诱导的大鼠 | 人类脂肪干细胞 | 纳米 | 1. 静脉注射2. 2 × 10 6 udADSC3.一次 | 1. 葡萄糖↓ 2. 胰岛素↑ | 1. ADSC改善STZ诱导的非肥胖小鼠的糖耐量受损、胰腺形态和细胞数量 2.与人ADSC共培养后胰岛存活率提高3.人ADSC分泌充足的VEGF和TIMP-1 4. ADSC通过联合局部旁分泌分泌减少细胞死亡 |
| STZ诱导的大鼠 | 大鼠脂肪干细胞 | CD54 +、 CD90 +、 MHC +、 CD45 –、MHC II 类- | 1.左肾被膜2. 胰岛(100毫克/公斤)3.一次 | 1. 葡萄糖↓ 2. 胰岛素↑ 3. C肽↑ | 1. 胰岛细胞与间充质干细胞共培养,分化效率更高 2. 胰岛细胞和间充质干细胞联合移植比单纯胰岛移植恢复更好 3. 胰岛细胞和间充质干细胞联合移植增加了胰岛素产生细胞的数量 |
| STZ 诱导的 Sprague-Dawley大鼠 | 大鼠脂肪干细胞 | CD29 +、CD90 +、CD34 – , CD31 – ,CD45 – , CD13 – | 1. 静脉注射2. 1 × 10 7 udADSC3. 连续天数 | 1. 葡萄糖↓ 2. 胰岛素↑ 3. 胆固醇↓4.甘油三酯↓ 5.尿素氮↓ 6.肌酐↓ | 1.自体ADSC减轻STZ引起的肾脏损伤 2. ADSC移植减轻STZ诱导的T1DM模型动物氧化应激 3. ADSC移植降低糖尿病肾脏中TNF-α、IL-1和IL-6的水平 4. ADSC移植抑制STZ诱导的MAPK信号通路的激活 |
| STZ 诱导的 Balb/c 小鼠 | 4 至 6 周 Sprague-Dawley 大鼠的大鼠 ADSC | CD29 +、CD90 +、CD34-、CD31- | 1. 静脉注射2. 1 × 10 6 udADSC3.一次 | 1. 葡萄糖↓2. 胰岛素↑ | 1. ADSC降低STZ诱导的空腹血糖水平 2. ADSC减轻STZ引起的胰腺损伤 3. ADSC增加STZ诱导受损胰岛的胰岛素分泌 |
| 模型 | 来源 | 细胞类型 | 管理/剂量(细胞数)/间隔 | 检测结果 | 改进 | 观察到的并发症/不良反应 |
|---|---|---|---|---|---|---|
| T1DM 患者 [ 62 ] | 人 ADSC 和造血细胞 | CD90 +、CD73 +、CD45- | 1. 门静脉注射2. 1.75 × 10 8 IPC3.一次 | 1. 葡萄糖↓2. C肽↑3. 糖化血红蛋白↓4.谷氨酸脱羧酶↓ | 1、治疗组患者平均糖化血红蛋白水平由10.99%下降至6.72%2、治疗组患者谷氨酸脱羧酶平均水平由331.10 IU/ml下降至123 IU/ml | 没有观察到不良影响 |
| T1DM 患者 [ 15 ] | 人类脂肪干细胞 | CD90 +、CD73 +、CD45 – | 1. 门静脉注射2. 2.025 × 10 6分泌胰岛素的 ADSC3.一次,第0天 | 1. 葡萄糖↓2. C肽↑3. 糖化血红蛋白↓4.外源性胰岛素需求量↓ | 治疗组患者的外源胰岛素需求下降至0.63U/kg/天,平均糖化血红蛋白水平下降至7.39%。血清中C肽水平增加至0.37ng/ml | 没有与干细胞输注或诱导治疗相关的不良/不良副作用 |
| T1DM 患者 [ 63 ] | 人类脂肪干细胞 | CD90 +、CD73 +、CD45- | 1. 门静脉注射2. 1.41 × 10 6分泌胰岛素的 ADSC3.一次,第0天 | 1. 葡萄糖↓2. C肽↑3. 糖化血红蛋白↓ | 在2.9个月的随访期间,治疗组患者的胰岛素需求量减少了30%–50%,血清C肽水平增加了 4–26 倍 | 没有与干细胞输注或诱导治疗相关的不良副作用 |
脂肪间充质干细胞治疗1型糖尿病的作用机制
ADSC与IPC的分化
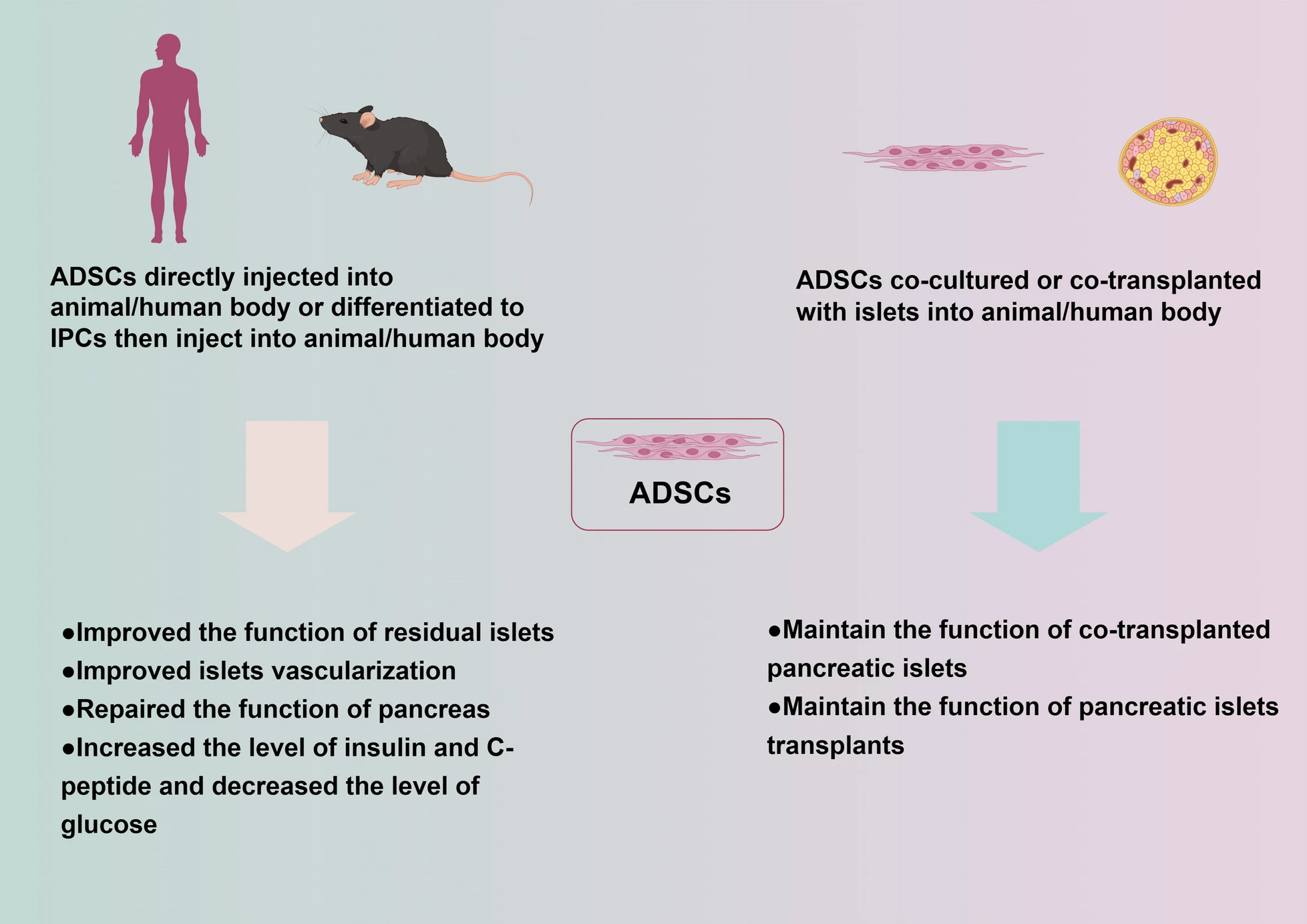
根据目前的研究,利用脂肪间充质干细胞治疗1型糖尿病的机制之一是将分化的IPC或ADSC移植到动物或人体内,并利用其分泌胰岛素的能力。蒂姆珀等人进行了第一个将人ADSC分化为IPC的实验。另一项研究中使用胰高血糖素样肽-1 (GLP-1) 诱导人ADSC分化为IPC。IPCs以葡萄糖浓度依赖性方式释放胰岛素和C肽。另外,将分化的IPC或未分化的ADSC注射到糖尿病动物体内导致糖尿病动物血清中胰岛素水平升高并恢复到正常血糖水平,如表1所示。
恢复体内残留胰岛的功能
ADSC不仅可以作为IPC的来源,还可以支持糖尿病患者残余胰岛的功能。在这些实验中,观察到注射ADSC或由ADSC分化的IPC后,残余胰腺的功能得以恢复。这些移植的ADSCs释放多种细胞因子,包括干扰素诱导蛋白10、嗜酸性粒细胞趋化因子(eotaxin)、血管内皮生长因子(VEGF)和金属蛋白酶组织抑制剂1(TIMP-1),所有这些细胞因子都可以阻止ADSC细胞凋亡β细胞并促进β细胞增殖。
此外,脂肪间充质干细胞移植可有效改善非肥胖糖尿病小鼠的糖尿病自身免疫机制,通过降低Th1免疫反应并诱导Tregs增殖来改善早发性自身免疫性糖尿病的高血糖水平。与未治疗的糖尿病组相比,IPCs移植组的胰腺再生能力增强,胰岛细胞数量、胰岛面积和密度以及C肽免疫反应面积显着增加。IPCs移植组胰岛中胶原纤维面积的百分比也下降。
在体内或体外维持胰岛移植物的功能
ADSC还可用于体外胰岛移植物的预处理,以增强移植胰岛的活力。现有研究表明,与单独培养的胰岛相比,体外共培养ADSC与同基因胰岛可显着提高胰岛素释放水平。这些预培养的胰岛移植物在移植过程中具有较高的成功率,并显着改善糖尿病小鼠的高血糖状况。ADSC中嗜酸细胞趋化因子、VEGF、TIPP-1、细胞外基质 (ECM) 成分、膜联蛋白A1和成纤维细胞生长因子2的表达似乎因旁分泌而上调胰岛和ADSC之间的通讯。
脂肪间充质干细胞在2型糖尿病中的应用
T2DM的特点是胰岛素反应组织中的胰岛素抵抗和胰腺β细胞的胰岛素分泌受损。这种类型的糖尿病占所有糖尿病病例的85-95%。此外,过度营养会导致脂肪组织炎症,影响多个组织并恶化胰岛素敏感性和β细胞功能。
目前,脂肪间充质干细胞治疗2型糖尿病的临床试验较少。大多数应用仍在动物实验中进行测试,这表明通过小鼠尾静脉、腹膜和肾囊注射ADSC可以通过恢复胰腺β细胞、减少炎症和增加胰岛素敏感性来改善高血糖。其中一些机制的探索为ADSCs的临床应用提供了新的方向。详细信息请参见表3。
| 模型 | 来源 | 细胞类型 | 管理/剂量(细胞数)/间隔 | 检测结果 | 改进 |
|---|---|---|---|---|---|
| STZ诱导的小鼠 | 小鼠附睾ADSC | CD105 +、CD29 +、CD45-、CD34- | 1.尾静脉注射2.5× 105udADSC3.一次 | 1. 胰岛素↑ 2. C肽↑ | 1. 细胞输注两周后,与 T2DM 组相比,接受 ADSC 的 T2DM 小鼠在 IPGTT 期间清除血糖的速度更快 2.胰岛素敏感性增加 3. ADSC输注可改善T2DM小鼠受损的胰岛并恢复β细胞4. ADSC的输注减少了HFD喂养引起的脂肪细胞的大小 |
| STZ 诱导的 Sprague-Dawley 大鼠 | 大鼠腹股沟脂肪干细胞 | CD44+、CD105+、CD90+、CD73+、CD34- 、CD45- | 1.尾静脉注射2. 2 × 10 6 udADSC3.一次 | 1. 葡萄糖↓ 2. C肽↑ 3. 糖化血红蛋白↓ 4. 重量↓ 5. 胰岛素↑ | 1、ADSC输注组caspase-3活性显着低于糖尿病对照组,但仍高于正常对照组 2、ADSC输注组vWF水平高于糖尿病对照组和正常对照组,说明ADSCs具有促进血管重建的作用 3. ADSC输注改善糖尿病大鼠的胰岛素敏感性 |
| STZ诱导的小鼠 | 小鼠脂肪干细胞 | CD90+、CD73+、CD105+、CD71+ | 1. 腹腔注射2. 1000–1200 第 10 天ICA3.一次 | 1. 葡萄糖↓ 2. C肽↑ 3. 胰岛素↑ | 移植4周后,取自小鼠的ICA仍然能够分泌C肽和胰岛素,并降低小鼠的血糖水平 |
| STZ诱导的 Sprague-Dawley大鼠 | 大鼠ADSC | 纳米 | 1.尾静脉注射2. 3 × 10 6 udADSC3.一次 | 1. 葡萄糖↓ | 1.注射ADSCs后两天,与对照组相比,血糖水平明显下降 2.注射ADSCs后3~24h,血糖水平较对照组缓慢下降,PI3K/p-AKT表达下降 3.注射ADSC可能通过增加AMPK磷酸化调节肝脏葡萄糖代谢相关酶的表达 |
脂肪间充质干细胞治疗2型糖尿病的作用机制
改善胰岛素抵抗
研究发现,体内ADSC移植可以恢复骨骼肌、肝脏和脂肪组织细胞膜上葡萄糖转运蛋白4和胰岛素受体的数量,并增加高脂饮食/STZ中胰岛素受体底物1的磷酸化。诱导T2DM大鼠模型。因此,这缓解了高血糖和胰岛素抵抗的状态。胰岛素抵抗可能与肥胖相关的全身慢性炎症有关,其中炎症因子可阻碍胰岛素信号通路中胰岛素受体底物和PI3K的磷酸化,导致信号转导受阻和胰岛素抵抗。
研究表明,注射ADSC后,T2DM大鼠体内的TNF-α、IL-6和IL-1β明显减少。注射ADSCs通过抑制促炎基因的表达来减轻肝脏重量和脂肪变性,并通过增加胰岛素受体底物的表达来降低胰岛素抵抗水平,表明注射ADSCs对肝脏脂肪变性有有利的作用。
促进胰岛素产生
除胰岛素抵抗外,胰腺β细胞功能障碍在T2DM的发生发展中也起着至关重要的作用。动物实验表明,不同来源的ADSCs在体外转化为IPCs并移植到小鼠体内后,与注射未分化ADSCs和空白组相比,可以有效降低血糖水平。ADSCs可以促进剩余胰岛功能的恢复并增加胰岛β细胞的数量。它们通过降低caspase-3活性来修复胰岛细胞,并通过分泌VEGF、胰岛素样生长因子1、肝细胞生长因子(HGF)和vWF等血管生成因子来促进胰岛血管化,从而有助于胰岛β的再生细胞。
调节肝脏葡萄糖代谢
输注ADSCs后24小时内,T2DM大鼠模型的高血糖状态可以迅速缓解。这种快速作用不能用改善β细胞功能和胰岛素抵抗来完全解释。肝脏通过调节糖原代谢和糖异生来维持正常的血糖水平。ADSC输注后24小时,T2DM大鼠模型的肝酶水平与葡萄糖代谢相关,这表明ADSC对葡萄糖稳态具有快速影响。然而,只有这一项研究报道了类似的现象,具体机制尚未明确阐明。
但值得注意的是,脂肪间充质干细胞治疗2型糖尿病的临床应用仍处于早期阶段,需要进一步研究以充分了解其安全性和有效性。许多技术和监管问题仍需要解决。尽管存在这些挑战,脂肪间充质干细胞治疗2型糖尿病的潜在益处是显着的,它们的使用代表了再生医学领域未来研究和开发的一个有前途的方向。
脂肪间充质干细胞在治疗糖尿病并发症中的应用
干细胞治疗糖尿病伤口
糖尿病伤口是糖尿病的慢性并发症,严重影响糖尿病患者的生活质量。糖尿病足溃疡是糖尿病伤口最严重的形式,临床表现为周围神经病变和下肢缺血,导致感觉障碍、肌肉萎缩、静息痛和坏死。此外,如果糖尿病伤口处理不当,可能会导致截肢甚至死亡。周围神经病变可降低糖尿病伤口的皮肤弹性和分泌功能,使糖尿病患者更容易在皮肤上形成伤口。在细胞水平上,DM损害巨噬细胞功能并阻止角质形成细胞和成纤维细胞在上皮愈合中发挥作用。此外,高血糖引起外周血管内皮损伤,进一步减少皮肤灌注,促进皮肤溃疡的形成。
目前,脂肪间充质干细胞在糖尿病创面治疗中的应用已经开展了大量的动物和临床人体实验,如表4和表5所示。
| 楷模 | 来源 | 管理/剂量(细胞数)/间隔 | 检测结果 | 改进 |
|---|---|---|---|---|
| STZ诱导的大鼠 | 人类脂肪干细胞 | 1. 伤口周围注射2. 3 × 10 6 ADSC3. 术后24小时 | 1、大体形态2. 组织学3.组织VEGF | 1. 25天后,ADSC治疗组大鼠的恢复率高于非糖尿病组(非治疗组糖尿病大鼠直到观察结束并非全部存活) 2. ADSC移植后25天,干细胞仍可识别并分散在肌肉组织中,无结构分化 3. ADSC移植后3天,血清VEGF水平显着高于非糖尿病组和糖尿病未治疗组 |
| 氯胺酮和甲苯噻嗪诱导的大鼠 | 人类脂肪干细胞 | 1.胶原蛋白凝胶直接覆盖伤口2.纳米3. 手术后立即 | 1.伤口大小2. 伤口的组织学 | 1.治疗10天后,ADSC组伤口尺寸明显小于未治疗组 2.创面组织学形态显示,ADSC治疗组疤痕真皮较未治疗组增厚 |
| STZ诱导的大鼠 | 大鼠脂肪干细胞 | 1. 伤口周围注射2. 1 × 10 6大鼠 ADSC3. 手术后立即 | 1. 伤口闭合区域2. 伤口的组织学3. 血管密度4. 免疫荧光分析 | 1. ADSC治疗组伤口完全闭合时间显着缩短2.组织学观察显示ADSC组的组织再生能力显着高于对照组3. 免疫荧光显示ADSCs融入再生表皮结构并增强伤口上皮化4. ADSC治疗显着增加了创面新生血管的形成,血管密度较对照组显着增加 |
| STZ 诱导的大鼠 | 大鼠SVF细胞 | 1. 将配制好的培养基直接涂抹在伤口上2. 5 × 10 5大鼠SVF细胞3. 手术后立即 | 1. 细胞因子水平2. 细胞数量3.肉芽组织区3. 血管密度 | 1. 与未处理的肉芽组织相比,SVF处理的大鼠的肉芽组织表现出延伸的相对增加2. SVF处理后的大鼠血管密度较未处理的血管密度显着增加 |
| 患者类型 | 患者编号 | 治疗类型 | 临床检测 | 结果 | 观察到的并发症/不良反应 |
|---|---|---|---|---|---|
| 1.下肢缺血性溃疡≥3cm2不愈 2.溃疡持续时间超过 3个月 3.截肢风险高 4.下肢 | 59 | 30×106自体SVF细胞伤口周围注射 | 1.溃疡大小 2. 闭馆时间 3. 血流速度 4. 动脉壁弹性 | 1. 6个月时,51名受试者糖尿病足溃疡闭合率为100%,8名受试者≥75%。12个月时,50名受试者的DFU 100%治愈,4名受试者的DFU治愈率≥85% 2.治疗初显反应时间为第2周至第20周,平均6.8周。溃疡创面愈合时间为第4周至第32周,平均愈合时间为21.6周 3. 在33条测量的血管中,32条(97%)显示收缩期峰值速度显着增加,其中11.4%显示胫骨前肌边缘的变化,31.1%显示更远端足背动脉的变化, 47.8% 的人表现出胫骨后肌的更显着变化 4. 测量的33条血管中,全部33条(100%)显示出血管弹性明显变化,其中胫骨前动脉(92.9%), | 观察到的不良反应与治疗无关 |
| 1. T1DM 和 T2DM 患者2. TcPO2<40毫米汞柱 3.截肢风险高 4.下肢 | 9 | 3.6 ± 0.2 × 10 7 个自体 SVF 细胞伤口周围注射 | 1. TcPO2值的变化2.皮肤微血管血流量水平 | 1.注射SVF细胞前,TcPO2平均值为31.3±7.4mmHg。注射后12周,TcPO2值增加至46.4±8.2mmHg,与第4周和第8周的基线相比有显着改善 2.注射SVF细胞前,测量的平均皮肤微血管血流量水平为34.0±21.1PU。12周时的血流量水平为76.1±32.5PU | 未发生与SVF细胞相关的不良事件注射 |
| 1.全层神经溃疡 2.病程>3周 3.下肢 | 10 | 基于SVF的全层真皮细胞移植 | 1.伤口面积变化率2.真皮和表皮的厚度和密度 | 1、干预组与对照组宏观上无显着差异,但干预组创面面积变化率优于对照组 2、皮肤扫描仪测量的皮下血管层厚度和密度,干预组明显高于对照组 | 治疗没有任何副作用 |
| 1. T1DM 和T2DM患者 2.伤口面积1-25cm 2,伤口深度瓦格纳I级和II级 3.下肢 | 59 | 人 ADSC 水凝胶 | 1. 伤口完全愈合的百分比 2.伤口愈合所需的平均时间 | 1. 第8周,治疗组73%和对照组47%实现完全愈合。到第12周时,治疗组的完全治愈率为82%,而对照组的完全治愈率为53% 2. 伤口完全闭合的中位Kaplan-Meier时间为治疗组28.5 天,对照组63.0天 | 没有与同种异体 ADSC 治疗相关的严重不良事件 |
| 1.T2DM患者 2.伤口面积10-20cm 2 3. 病程>4周 4. Wagner1级和2级病变和伤口深度 5.下肢 | 20 | 6×106人 ADSC注射 | 1.伤口愈合率 2. 平均伤口愈合时间 | 1.治疗组平均愈合时间为31.0±10.7天,对照组平均愈合时间为54.8±15.0天2. 20个病灶中,17个已完全愈合,其中治疗组9个,对照组8个 | 平均随访 43.4 ± 8.7 个月后,ADSC 组没有出现不良事件或并发症 |
| 1.糖尿病T1DM/TT2DM患者 2.筛查时有溃疡病史超过4周。 3. 伤口尺寸在1至 25cm2之间 4.瓦格纳I/II级伤口深度 5.下肢 | 59 | 1×106同种异体 ADSC/片 | 1.伤口愈合率 2.伤口愈合时间 | 1. 59例糖尿病足溃疡患者随机分为ADSCs治疗组和聚氨酯膜对照组。第8周时,ADSC治疗组的伤口完全闭合率为73%,而对照组为47%。第12周时,ADSC治疗组的伤口完全闭合率为82%,而对照组为53%。ADSC治疗组和对照组的伤口闭合中位时间分别为28.5天和63.0天2.治疗组第1周伤口尺寸缩小率为49.6±25.7%,对照组为23.0±32.2%(P=0.007)。在12个研究周中的第9周,两组之间的伤口尺寸缩小率也具有统计学显着性 | 没有与同种异体 ADSC治疗相关的严重不良事件 |
在一项研究中,6个月时,51名受试者的糖尿病足溃疡闭合率为100%,8名受试者的糖尿病足溃疡闭合率≥75%。12个月时,50名受试者的DFU100%治愈,4名受试者≥85%治愈。
在另一项研究中,59名糖尿病足溃疡患者被随机分为脂肪间充质干细胞治疗组和聚氨酯薄膜对照组。第8周时,脂肪间充质干细胞治疗组的伤口完全闭合率为73%,而对照组为47%。第12周时,脂肪间充质干细胞治疗组的伤口完全闭合率为82%,而对照组为53%。脂肪间充质干细胞治疗组和对照组伤口闭合的中位时间分别为28.5天和63.0天。接受同种异体脂肪间充质干细胞注射组伤口愈合时间为31天,明显短于对照组。
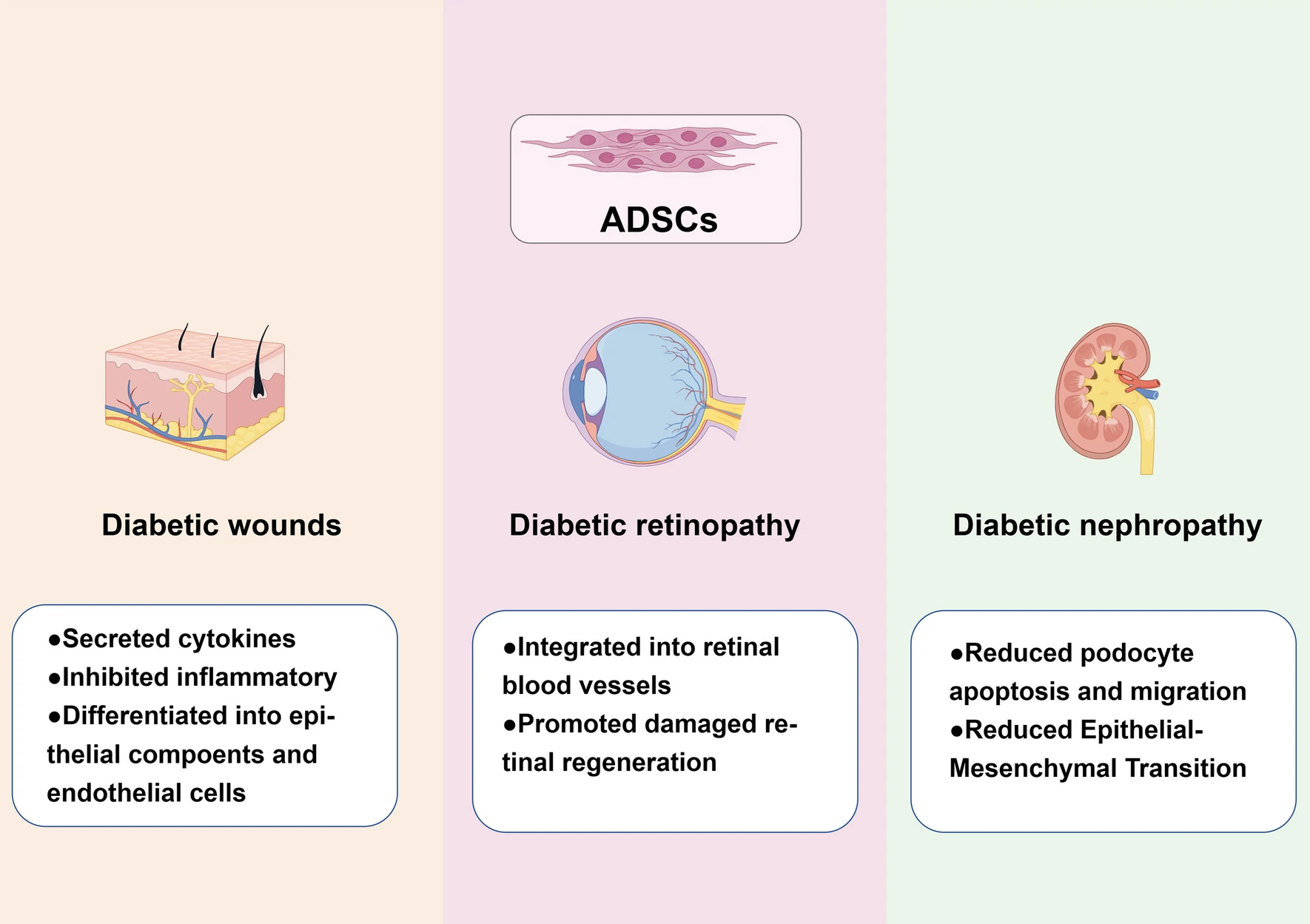
根据现有研究,脂肪间充质干细胞治疗糖尿病伤口有几种可能的机制。脂肪间充质干细胞具有旁分泌功能,可以分泌多种细胞因子,如VEGF、成纤维细胞生长因子2、角质形成细胞生长因子、TGF-β、血小板源性生长因子、HGF和胶原蛋白等。脂肪间充质干细胞还具有直接分化为上皮成分和内皮细胞的能力,在真皮重塑和伤口愈合中发挥重要作用。
此外,脂肪间充质干细胞还可以通过旁分泌功能抑制糖尿病伤口的炎症反应。应用脂肪间充质干细胞后,糖尿病创面中IL-6、IL-8和TNF-α的表达显着下调,炎症细胞浸润减少。
现有研究证实脂肪间充质干细胞可以促进调节、新生血管形成和纤维化,可作为治疗糖尿病伤口的潜在疗法。然而, 脂肪间充质干细胞在人体中应用的临床实验还相对较少。需要进一步研究确定更有效的利用脂肪间充质干细胞治疗糖尿病患者创伤或手术伤口的方法,以达到治疗糖尿病伤口的目的。
糖尿病性视网膜病变
糖尿病视网膜病变是一种由视网膜缺血引起的视网膜微血管疾病。越来越多的证据表明,糖尿病相关的神经变性发生在视网膜血管内皮变化之前,这表明糖尿病视网膜病变应被视为一种神经血管变性疾病。
目前,糖尿病视网膜病变的主要治疗仍然旨在控制血糖以减缓疾病的进展。当疾病进展为黄斑水肿或威胁视力的增殖性糖尿病视网膜病变时,临床上可采用激光治疗破坏周围视网膜,减少需氧量,有助于缓解病情;然而,激光治疗可能会导致许多并发症,例如视力下降、视网膜增厚和视野丧失。
最近,一些研究探索了利用脂肪间充质干细胞治疗糖尿病视网膜病变的新方法。该方法基于ADSC分化为周细胞的能力,可以防止神经血管损伤并促进受损视网膜的再生,从而实现糖尿病视网膜病变的治疗。
总体而言,根据目前的观点,脂肪间充质干细胞可能成为未来治疗糖尿病视网膜病变的潜在方法。然而,确定脂肪间充质干细胞的最佳移植方法和定位仍然是一个挑战。目前的研究主要集中在局部或静脉注射ADSCs,还需要进一步的研究来确保细胞注射入眼后在受损视网膜区域的准确定位。此外,目前利用ADSC治疗糖尿病视网膜病变的研究仅限于动物实验,距离ADSC作为实际的治疗方法还有很长的路要走。
干细胞治疗糖尿病肾病
糖尿病肾病(DN)是终末期肾病的主要原因,也是T1DM和T2DM患者的主要原因。DN的主要特征是肾功能和形态异常。肾小球形态异常包括肾小球体积增大、足细胞损伤、ECM逐渐积累、系膜基质扩张、肾小球基底膜增厚以及肾小球硬化和间质纤维化的出现。功能异常包括蛋白尿、肾小球滤过率降低以及肾小球灌注和滤过增加。长期高血糖、高血压和局部炎症可导致肾小球和肾小管间质进行性、不可逆的损伤,最终导致肾功能障碍,最终进展为肾衰竭。
越来越多的证据表明,源自干细胞的外泌体在治疗大鼠或小鼠模型的肾脏疾病方面相对安全有效。MSCs分泌的外泌体在急性肾损伤和慢性肾脏疾病中发挥着重要的保护作用。外泌体是由各种类型的细胞(包括间充质干细胞)释放的纳米级膜囊泡。microRNA可以被封装在外泌体中,并作为潜在的旁分泌调节因子参与许多疾病的调节,例如缺血性疾病和退行性眼病。MSCs产生的microRNA,如miR-150和miR-134,在DN治疗中发挥着至关重要的作用。人尿干细胞分泌的外泌体通过miR16-5p的转移减轻DN和高糖诱导的足细胞损伤。因此,一些研究人员尝试利用ADSCs-Exos来达到治疗DN的目的,并成功不同程度地改善了足细胞的功能损伤和DN症状。
综上所述,根据目前的结果,ADSCs-Exo在糖尿病肾病的治疗中具有潜在的治疗作用,未来可能是治疗DN的一个相对较好的选择。但仍存在一些问题需要解决,如优化ADSC细胞外囊泡的制备方法、确定细胞外囊泡中的活性分子、探索将细胞外囊泡准确递送至肾脏的方法等。这些将有助于将脂肪干细胞转化为临床应用。
最近的研究表明肝脏变化是糖尿病的另一个并发症。
DM引起的高血糖会增加肝损伤和肝纤维化的风险,严重影响患者的健康和生活质量。DM与肝脏疾病密切相关,但DM肝脏变化的病理生理基础和进展尚不完全清楚,缺乏有效的早期干预。一些研究尝试将ADSCs移植到动物体内来减轻糖尿病引起的肝损伤和纤维化,并取得了一定的积极结果。这为进一步研究和开发ADSCs治疗DM相关肝病提供了重要的理论和实验基础。但目前尚未进行临床试验,对ADSCs的治疗机制和通路的解释还不够详细,需要进一步的研究来阐明。
结论
总之,越来越多的研究表明脂肪间充质干细胞可能成为治疗糖尿病的新方法。脂肪间充质干细胞治疗有可能改善动物和人类的高血糖水平并减轻相关并发症的症状。然而,要将脂肪间充质干细胞转化为实际的临床应用,还有很多工作要做。
需要进一步的研究和临床观察来评估脂肪间充质干细胞治疗的长期效果,并尽量减少与其使用相关的潜在风险,以便在未来的临床应用中获得更可靠和有效的益处。
参考资料:Yan, D., Song, Y., Zhang, B. et al. Progress and application of adipose-derived stem cells in the treatment of diabetes and its complications. Stem Cell Res Ther 15, 3 (2024). https://doi.org/10.1186/s13287-023-03620-0
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信