概括:使用间充质干细胞(MSC)进行骨关节炎的关节内治疗已显示出良好的结果,并且正在越来越多地在临床中实施。自体干细胞是治疗的主要来源,但与细胞扩增、患者年龄和急性治疗相关的问题引发了对同种异体MSC的需求。然而,在第一次至第二次治疗中使用同种异体间充质干细胞时,报告了有问题的免疫反应,如疼痛、关节肿胀、荨麻疹和MSC破坏。正如本综述所述,在决定自体或同种异体间充质干细胞治疗时需要考虑多种因素。
骨关节炎是一种疼痛、退行性和炎症性关节疾病。不幸的是,尚无有效治愈或减缓疾病的治疗方法,但近几十年来,间充质干细胞 (MSC) 治疗在关节愈合、延缓疾病进展和缓解疼痛方面显示出良好的效果。
研究表明,间充质干细胞通过直接分化、局部祖细胞的旁分泌激活以及调节免疫系统使环境变得更有利于愈合来发挥作用。在临床上,自体间充质干细胞主要用于骨关节炎治疗,但与细胞增殖、患者年龄和急性治疗相关的问题引发了对同种异体干细胞治疗骨关节炎的渴望。
同种异体移植的一个挑战是潜在的免疫异物反应,当受体的免疫细胞识别出细胞表面的主要组织相容性复合体(MHC)与其自身不同时,就会引发这种反应。MHC有两个类别(I和II),又分为几个人类白细胞抗原亚类。
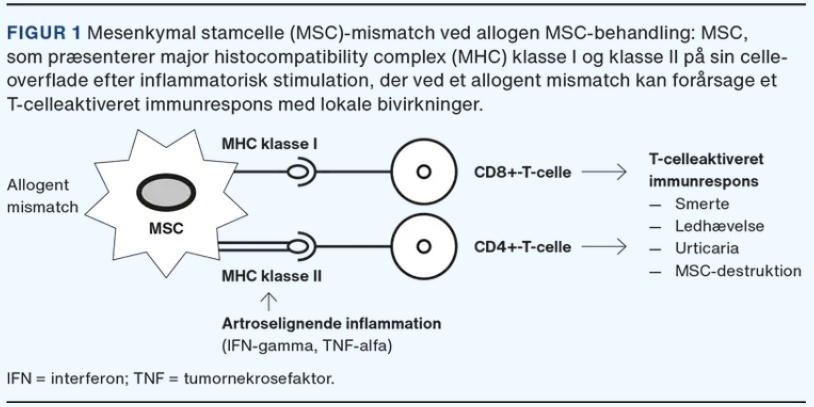
历来认为MSC不含MHCII类,并且具有非常低水平的MHCI类,利用MHCI类,它们可以逃避/最小化T细胞识别和不需要的免疫反应,理论上允许同种异体干细胞治疗。然而,最近的研究表明,不幸的是情况并非总是如此,因为已在MSC表面鉴定出I类和II类MHC的异质类型。体外研究表明,在炎症因子刺激后,间充质干细胞中MHCII类的表达上调,而炎症因子在骨关节炎关节中升高。MHC错配可能会在同种异体治疗期间引起免疫反应,这已在从第一次治疗到第二次治疗的重复治疗中得到证实(图1)。
用于治疗骨关节炎的同种异体、市售人类干细胞产品目前正在欧盟开发,并已在亚洲和欧盟市场上销售。自体和同种异体干细胞疗法越来越多地用于骨关节炎患者,使得对相关优点和缺点以及为个体患者选择最合适的治疗方法而需要考虑的因素进行基于证据的讨论变得非常重要。因此,这篇状态文章的目的是阐明自体干细胞与异体干细胞治疗骨关节炎的优点和缺点。
自体间充质干细胞治疗关节炎
从各种类型的组织(包括脂肪组织和骨髓)中收获的间充质干细胞用于骨关节炎的关节内治疗。临床研究表明,其具有积极作用,可降低疼痛评分、减少软骨破坏,并且在一些研究中还可以增加再生软骨的形成。
目前,自体间充质干细胞治疗主要用于骨关节炎患者,即从患者自身采集干细胞。从这里开始,干细胞要么直接在手术室中进行一步操作,例如微碎片脂肪组织和浓缩骨髓抽吸物,要么在实验室中进一步纯化和增殖后使用。与扩增MSC治疗(通常为10-100×106)相比,一步程序中的干细胞数量相对较低(通常<1×106) 。
对扩增细胞的MSC剂量反应研究表明,较高剂量在骨关节炎治疗中具有更好的长期效果。因此,通过注射前细胞的体外增殖可以潜在地改善间充质干细胞治疗。细胞的增殖需要良好的生产实践实验室以及多个监管许可。此外,细胞增殖既耗时又昂贵,因此排除了用增殖的自体细胞进行急性治疗。这可能是有问题的,因为间充质干细胞治疗骨关节炎已显示出主要在骨关节炎早期阶段的软骨保护和再生效果。
研究还表明,间充质干细胞的分裂能力有限,大量的细胞复制会对间充质干细胞产生负面影响,使它们无法再形成软骨和骨组织,而是变得“衰老”(衰老)并分泌抑制性信号传导物质对周围细胞的影响。因此,起始材料中的细胞数量必须足够高,以便大规模生产不会对细胞造成损害。
如果使用自体高剂量间充质干细胞进行重复治疗时细胞需求较高,则MSC有限的增殖能力可能会出现问题,这可能会延长积极的治疗效果。在I/II期随机对照试验中,Matas等人表明,在12个月的随访中,两次MSC治疗膝骨关节炎(间隔6个月)比单次治疗对疼痛评分有更好的效果。然而, Freitag等人在比较膝骨关节炎的一种或两种MSC治疗方法时发现疼痛评分没有差异。然而, Freitag等人的研究使用的MSC (100 ×106) 是Matas等人(20×106)的五倍,这可能是一个促成因素。
多项研究表明,间充质干细胞的数量和质量随着供体年龄的增加而下降,通常在50岁左右报告显着下降。一些研究表明没有年龄影响,并且与骨髓MSC相比,脂肪组织MSC对衰老的敏感性较低。因此,细胞数量和细胞增殖可能是自体治疗中的限制因素,而在同种异体治疗中,这不是一个挑战,因为异体治疗中可以使用来自多个(年轻)供体的细胞。因此,在自体治疗和干细胞类型的选择时应考虑患者的年龄,这可能是一个挑战,因为骨关节炎经常发生在老年患者中。
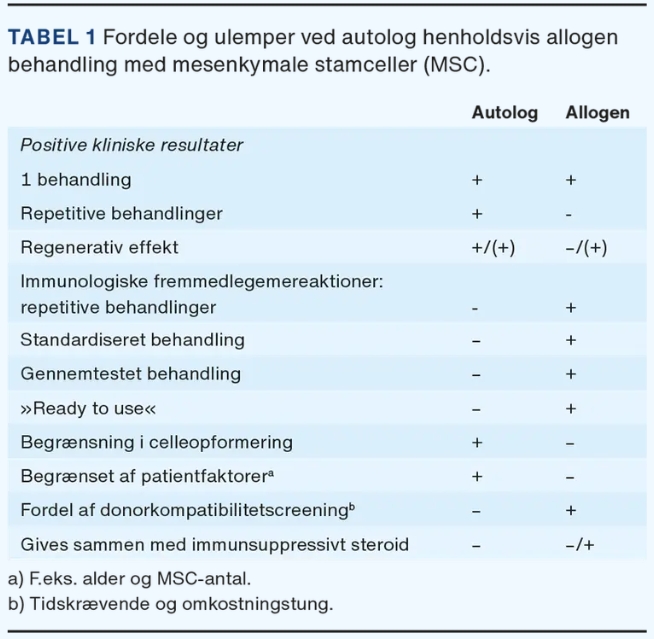
自体治疗的明显优势是异物反应的风险最小化,并且无需筛选供体兼容性(表1)。与培养细胞相比,封闭式自体一步式手术所需的监管许可更少,感染风险也更低。Wiggers等人进行的系统评价包括408名膝骨关节炎患者的14项自体MSC治疗随机对照试验,其中进行了1次 (79%)、2次 (14%) 或3次 (7%) 关节内治疗。研究表明,治疗一年后,与对照组相比,间充质干细胞治疗后26项患者报告的结果测量 (PROM) 中有19项 (73%) 显着改善。随机对照试验通常质量参差不齐,其中一些试验存在较高的结果偏倚风险,但在治疗后四年内,任何随机对照试验基本上都未报告自体间充质干细胞治疗的显着副作用。
同种异体间充质干细胞治疗关节炎
商业化的同种异体间充质干细胞治疗骨关节炎将很有吸引力。单次注射同种异体MSC已用于多项骨关节炎研究,临床改善且无明显副作用。
- Copp等人的一项审查表明,六分之五 (83%) 的骨关节炎临床试验采用同种异体、扩展MSC治疗,导致PROM显着改善。当用自体MSC治疗时,这个数字是九分之八 (89%)。然而,
- Frisbie等人的一项研究报告称,与同种异体间充质干细胞治疗相比,单次注射自体间充质干细胞可以对软骨损伤产生更好的再生反应,增加骨赘和软骨形成,但在大多数参数上,这种治疗并不比仅注射纤维蛋白凝胶明显更好。
- de Windt等人的I期研究进一步表明,通过用同种异体间充质干细胞治疗软骨损伤获得的再生组织仅由患者自身的DNA组成,并且同种异体间充质干细胞的主要作用是通过旁分泌信号传导。
然而,MHC错配已被证明会导致重复同种异体治疗的免疫反应。同种异体间充质干细胞治疗的副作用包括关节疼痛、关节肿胀、荨麻疹和MSC破坏。这是有问题的,因为骨关节炎的重复MSC治疗可能会产生更好的长期结果。
如果MSC暴露于骨关节炎样炎症刺激,它们也可以上调其MHCII类表达。Oh等人的一项研究表明,在正常生长条件下,1.1%的人骨髓间充质干细胞表面具有II类MHC,但在肿瘤坏死因子-α的炎症刺激后,这种情况上调至28.7%的间充质干细胞,发现关节炎关节中的浓度增加。这使得仅使用MHCII类阴性MSC进行同种异体治疗存在问题,因为MSC在注射到骨关节炎关节后将暴露于炎症。然而,通过敲除I类和II类MHC的基因操作,使该基因不再存在于MSC中,已显示出MSC在移植到不匹配的免疫活性小鼠后具有存活的潜力。
在治疗前可以对患者和供体进行单倍型分析和匹配,但涉及一个耗时且昂贵的过程,这就是为什么目前在同种异体细胞的临床骨关节炎研究中没有进行这种操作。此外,由于MSC增殖能力有限,同种异体治疗通常包含来自多个供体的MSC,这使得完全匹配变得困难。特征明确的干细胞库可以帮助解决这个问题。
细胞记忆被进一步认为是同种异体异物反应的原因。
- 2014年, Ryan等人表明,在同种异体大鼠模型中,间充质干细胞分化为软骨细胞会导致其基因表达发生变化,从而导致它们失去免疫抑制能力,并被同种异体T细胞降解。细胞发起的免疫反应。分化的人类间充质干细胞在体外也失去了免疫抑制能力。未分化的间充质干细胞在大鼠模型中引起的免疫反应明显较低,但在再生关节治疗中,立即需要间充质干细胞的高分化能力,这与它们的旁分泌信号一起可以促进关节的再生。可能需要不良免疫抑制类固醇治疗来降低异物反应的风险。
同种异体疗法的优点是一种更加标准化和经过测试的治疗方法,可以快速使用 – 最好来自最佳供体。从具有高干细胞潜力的(年轻)供体中选择间充质干细胞是可能的,这可能会改善(老年)骨关节炎患者的治疗效果。来自多个供体的细胞也可以用于商业用途的大规模细胞增殖(表1)。
讨论与结论
使用自体和同种异体间充质干细胞治疗骨关节炎已显示出有希望但各不相同的结果。这可能是由于研究设计、患者年龄、采集组织和方法、MSC剂量、治疗次数等方面的差异所致。
据报道,使用自体间充质干细胞对患者来说是安全的,而同种异体治疗可能会发生免疫异物反应,特别是重复注射。如果自体治疗遇到困难,例如患者年龄较大和迫切需要治疗,可以考虑单一同种异体间充质干细胞治疗。
目前,关于自体或同种异体间充质干细胞治疗骨关节炎患者的普遍使用尚无定论。用间充质干细胞治疗骨关节炎仍必须被视为实验性的,并且只能在受控的环境中进行,并对患者进行结构化的随访。
参考文献:
- Matas J, Orrego M, Amenabar D et al. Umbilical cord-derived mesenchymal stromal cells (MSCs) for knee osteoarthritis: repeated MSC dosing is superior to a single MSC dose and to hyaluronic acid in a controlled randomized phase I/II trial. Stem Cells Transl Med. 2019;8(3):215-224. doi: 10.1002/sctm.18-0053.
- Lamo-Espinosa JM, Mora G, Blanco JF et al. Intra-articular injection of two different doses of autologous bone marrow mesenchymal stem cells versus hyaluronic acid in the treatment of knee osteoarthritis: multicenter randomized controlled clinical trial (phase I/II). J Transl Med. 2016;14(1):246. doi: 10.1186/s12967-016-0998-2.
- Andersen C, Uvebrant K, Mori Y et al. Human integrin α10β1-selected mesenchymal stem cells home to cartilage defects in the rabbit knee and assume a chondrocyte-like phenotype. Stem Cell Res Ther. 2022;13(1):206. doi: 10.1186/s13287-022-02884-2.
- Li JJ, Hosseini-Beheshti E, Grau GE et al. Stem cell-derived extracellular vesicles for treating joint injury and osteoarthritis. Nanomaterials (Basel). 2019;9(2):261. doi: 10.3390/nano9020261.
- Danisovic L, Oravcova L, Krajciova L et al. Effect of long-term culture on the biological and morphological characteristics of human adipose tissue-derived stem cells. J Physiol Pharmacol. 2017;68(1):149-158.
- Bagge J, Berg LC, Janes J et al. Donor age effects on in vitro chondrogenic and osteogenic differentiation performance of equine bone marrow- and adipose tissue-derived mesenchymal stromal cells. BMC Vet Res. 2022;18(1):388. doi: 10.1186/s12917-022-03475-2.
- Frederiksen HR, Doehn U, Tveden-Nyborg P et al. Non-immunogenic induced pluripotent stem cells, a promising way forward for allogenic transplantations for neurological disorders. Front Genome Ed. 2021;2:623717. doi: 10.3389/fgeed.2020.623717.
- Schnabel LV, Pezzanite LM, Antczak DF et al. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 2014;5(1):13.
- Oh JY, Kim H, Lee HJ et al. MHC class I enables MSCs to evade NK-cell-mediated cytotoxicity and exert immunosuppressive activity. Stem Cells. 2022;40(9):870-882. doi: 10.1093/stmcls/sxac043.
- Eliopoulos N, Stagg J, Lejeune L et al. Allogeneic marrow stromal cells are immune rejected by MHC class I- and class II-mismatched recipient mice. Blood. 2005;106(13):4057-65. doi: 10.1182/blood-2005-03-1004.
- Pezzanite LM, Fortier LA, Antczak DF et al. Equine allogeneic bone marrow-derived mesenchymal stromal cells elicit antibody responses in vivo. Stem Cell Res Ther. 2015;6(1):54. doi: 10.1186/s13287-015-0053-x.
- Joswig AJ, Mitchell A, Cummings KJ et al. Repeated intra-articular injection of allogeneic mesenchymal stem cells causes an adverse response compared to autologous cells in the equine model. Stem Cell Res Ther. 2017;8(1):42. doi: 10.1186/s13287-017-0503-8.
- Lee WS, Kim HJ, Kim K Il et al. Intra-articular injection of autologous adipose tissue-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase IIb, randomized, placebo-controlled clinical trial. Stem Cells Transl Med. 2019;8(6):504-511. doi: 10.1002/sctm.18-0122.
- Wiggers TG, Winters M, van den Boom NA et al. Autologous stem cell therapy in knee osteoarthritis: a systematic review of randomised controlled trials. Br J Sports Med. 2021;55(20):1161-1169. doi: 10.1136/bjsports-2020-103671.
- Hudetz D, Borić I, Rod E et al. The effect of intra-articular injection of autologous microfragmented fat tissue on proteoglycan synthesis in patients with knee osteoarthritis. Genes (Basel). 2017;8(10):270. doi: 10.3390/genes8100270.
- Bagge J, Hölmich P, Nehlin JO et al. Microfragmentation for processing stem cells from adipose tissue is promising when compared to enzymatic digestion for the treatment of osteoarthritis. Scandinavian Sports Medicine Congress, 2022.
- Copp G, Robb KP, Viswanathan S. Culture-expanded mesenchymal stromal cell therapy: does it work in knee osteoarthritis? A pathway to clinical success. Cell Mol Immunol. 2023;20(6):626-650. doi:10.1038/s41423-023-01020-1.
- Freitag J, Bates D, Wickham J et al. Adipose-derived mesenchymal stem cell therapy in the treatment of knee osteoarthritis: a randomized controlled trial. Regen Med. 2019;14(3):213-230. doi: 10.2217/rme-2018-0161.
- Zhou S, Greenberger JS, Epperly MW et al. Age-related intrinsic changes in human bone-marrow- derived mesenchymal stem cells and their differentiation to osteoblasts. Aging Cell. 2008;7(3):335-43. doi: 10.1111/j.1474-9726.2008.00377.x.
- Choudhery MS, Badowski M, Muise A et al. Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation. J Transl Med. 2014;12:8. doi: 10.1186/1479-5876-12-8.
- Justesen J, Stenderup K, Eriksen EF et al. Maintenance of osteoblastic and adipocytic differentiation potential with age and osteoporosis in human marrow stromal cell cultures. Calcif Tissue Int. 2002;71(1):36-44. doi: 10.1007/s00223-001-2059-x.
- Chen HT, Lee MJ, Chen CH et al. Proliferation and differentiation potential of human adipose-derived mesenchymal stem cells isolated from elderly patients with osteoporotic fractures. J Cell Mol Med. 2012;16(3):582-93. doi: 10.1111/j.1582-4934.2011.01335.x.
- Geburek F, Mundle K, Conrad S et al. Tracking of autologous adipose tissue-derived mesenchymal stromal cells with in vivo magnetic resonance imaging and histology after intralesional treatment of artificial equine tendon lesions – a pilot study. Stem Cell Res Ther. 2016;7:21. doi: 10.1186/s13287-016-0281-8.
- Vega A, Martín-Ferrero MA, Del Canto F et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial. Transplantation. 2015;99(8):1681-90. doi: 10.1097/TP.0000000000000678.
- Song JS, Hong KT, Kim NM et al. Implantation of allogenic umbilical cord blood-derived mesenchymal stem cells improves knee osteoarthritis outcomes: Two-year follow-up. Regen Ther. 2020;14:32-39. doi: 10.1016/j.reth.2019.10.003.
- de Windt TS, Vonk LA, Slaper-Cortenbach ICM et al. Allogeneic mesenchymal stem cells stimulate cartilage regeneration and are safe for single-stage cartilage repair in humans upon mixture with recycled autologous chondrons. Stem Cells. 2017;35(1):256-264. doi: 10.1002/stem.2475.
- Frisbie DD, McCarthy HE, Archer CW et al. Evaluation of articular cartilage progenitor cells for the repair of articular defects in an equine model. J Bone Joint Surg Am. 2015;97(6):484-93. doi: 10.2106/JBJS.N.00404.
- Nauta AJ, Westerhuis G, Kruisselbrink AB et al. Donor-derived mesenchymal stem cells are immunogenic in an allogeneic host and stimulate donor graft rejection in a nonmyeloablative setting. Blood. 2006;108(6):2114-20. doi: 10.1182/blood-2005-11-011650.
- Halm D, Leibig N, Martens J et al. Direct comparison of the immunogenicity of major histocompatibility complex-I and -II deficient mesenchymal stem cells in vivo. Biol Chem. 2021;402(6):693-702. doi: 10.1515/hsz-2020-0306.
- Ryan AE, Lohan P, O’Flynn L et al. Chondrogenic differentiation increases antidonor immune response to allogeneic mesenchymal stem cell transplantation. Mol Ther. 2014;22(3):655-667. doi: 10.1038/mt.2013.261.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。



 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号