概述:骨关节炎(OA)是最常见的关节退行性疾病,其主要病理特征是不可逆的软骨损伤。随着再生医学的发展,间充质干细胞(MSCs)被发现具有强大的治疗潜力。本文综述了间充质干细胞-干细胞外泌体在骨关节炎治疗中的作用机制、间充质干细胞-干细胞外泌体的制备研究现状及其在OA治疗中的给药应用。
简介
骨关节炎(OA)是最常见的关节炎形式之一。 2021年的数据表明,40岁及以上的成年人中有22%患有膝关节骨关节炎。据估计,全球有超过5亿人受到OA的影响,使其成为导致残疾的第四大原因。它给医疗保健资源带来巨大负担,加上失业和提前退休造成的生产力损失,带来了重大的社会挑战。骨关节炎是一种复杂的退行性疾病,涉及滑膜关节内的各种成分。其主要病理特征包括关节软骨丧失、软骨下骨重塑、滑膜组织炎症变化以及肌腱和韧带不稳定。其中,软骨的不可逆损伤长期以来一直是治疗的挑战。
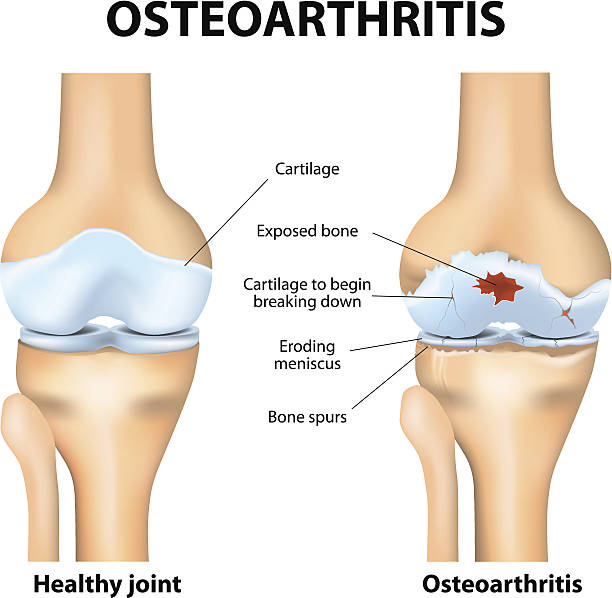
由于软骨组织的无血管性质,其自我修复能力受到严重限制。成熟软骨细胞的增殖能力有限,仅靠周围软骨细胞的合成和代谢不足以填补软骨缺损。目前,临床上可用于治疗软骨损伤的药物很少。口服药物很难在关节腔内达到有效浓度,甚至关节内注射也会很快被淋巴液吸收,导致治疗效果短暂并增加感染风险。因此,研究更有效的靶向治疗和有效的药物输送系统至关重要。
近年来,研究人员不断开发生长因子、抗炎剂和富血小板血浆(PRP)等新型生物制剂,试图通过滋养软骨和抑制关节内炎症反应来减缓骨关节炎的进展。间充质干细胞(MSC)是一种多能干细胞,以其自我更新和多谱系分化能力而闻名。它们可以通过旁分泌作用影响生物过程,表现出抗炎、镇痛和免疫调节特性,在软骨修复研究中已显示出有希望的结果。
源自间充质干细胞的外泌体 (MSC-Exos) 含有多种蛋白质、mRNA和miRNA,在细胞间通讯中发挥着至关重要的作用。与MSC相比,间充质干细胞外泌体具有安全性更高、易于储存、副作用最小和道德问题更少等优势。生物技术的进步进一步发挥了它们在药物输送系统中的潜力。本综述重点关注间充质干细胞外泌体在OA治疗中的临床前景。总结了其生物学特性、制备方法,并探讨了它们作为骨关节炎治疗药物递送系统的潜力。
间充质干细胞和间充质干细胞外泌体在骨关节炎进展中的作用
间充质干细胞主要来源于骨髓,分泌多种细胞因子,包括胰岛素样生长因子1、转化生长因子-β和血小板衍生生长因子,参与修复过程。损伤后两周内,间充质干细胞转化为软骨细胞样细胞,合成并分泌富含II型胶原和蛋白聚糖的新ECM。这种组织类似于透明软骨,可以填充缺损。六到八周后,这种新形成的组织可能从纤维软骨转变为透明软骨。然而,即使缺陷被成功填充,所得软骨也会表现出硬度降低和抗压缩性低,使其在机械负载下容易受到进一步损坏。从长远来看,邻近的软骨细胞也可能受到影响,增加骨关节炎扩散到最初局部区域之外的风险。
细胞外囊泡(EV)被认为是细胞间通讯的重要介质。它们在关节内OA进展中的作用受到越来越多的关注。软骨细胞释放的外泌体对OA有双重作用。健康软骨细胞分泌的EV可以调节M2巨噬细胞的渗透,促进线粒体功能障碍的消除,促进免疫恢复。然而,来自OA软骨细胞的EVs促进miR-449a-5p/ATG4B介导的自噬,抑制软骨细胞增殖,增强软骨细胞凋亡,并上调巨噬细胞促炎介质的产生。
大量研究表明,源自间充质干细胞(MSC)的外泌体可以减缓OA的进展。许多学者已经证明,基于MSC 的OA治疗主要通过EV发挥作用,传递包括小RNA在内的物质。这些物质调节多种生物活性,例如软骨细胞凋亡和衰老、滑膜细胞增殖以及促炎介质的释放。EV根据其特性和来源表现出特定的细胞靶向特性,并且具有生物相容性。因此,人们进行了大量的研究工作来利用MSC-Exos来延迟OA的开发。工程技术的不断进步旨在开发基于MSC-Exos的药物输送系统,为OA治疗的新方法铺平道路。
间充质干细胞外泌体的生物学特性
外泌体的结构
外泌体的直径约为40-100nm,构成生物纳米级球形脂质双层囊泡的子集,已发现大多数细胞类型都能分泌该囊泡。 “外泌体”一词最初由Trams等人于1981年创造。指源自质膜的囊泡。这些囊泡被认为具有 5′-核苷酸酶活性,可能具有生理功能,并且源自不同细胞系培养物的挤出。由于外泌体亚型之间和内部固有的异质性以及重叠的特征,将外泌体与其他细胞外囊泡(EV)(例如微泡(MV)和凋亡小体(AB))区分开来可能具有挑战性。值得注意的是,外泌体被发现封装了丰富的生物活性物质,包括蛋白质、核酸、脂质、细胞因子、转录因子受体等。
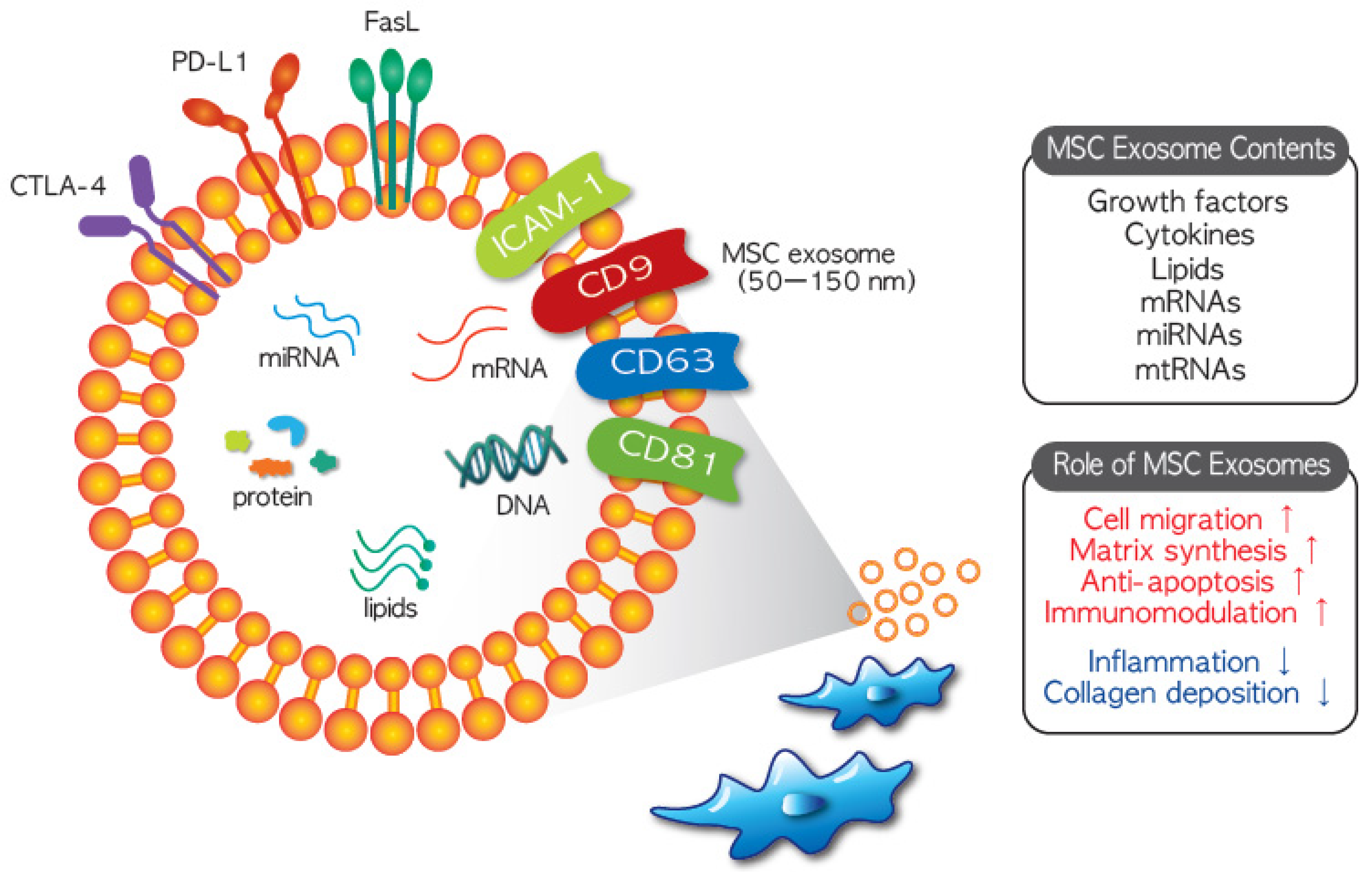
外泌体质膜的成分包含多种脂质,包括己糖神经酰胺、胆固醇、磷脂酰丝氨酸、鞘磷脂和饱和脂肪酸。
外泌体蛋白成分可大致分为两类:常见成分,是囊泡形成和分泌不可或缺的部分;以及特定成分,与起源细胞密切相关。常见成分包括一系列在膜转运和融合(例如 Rab GTPases)、热休克反应(例如 HSP70、HSP90)、属于四跨膜蛋白超家族的蛋白质等过程中发挥关键作用的蛋白质(例如CD63,CD81),转运所需的内体分选复合物(ESCRT)相关蛋白(如Tsg101,Alix),整合素等。 另一种是特异性成分,与它们的祖细胞密切相关,包括细胞特异性CD45和MHC-II等标记物源自抗原呈递细胞。
间充质干细胞外泌体的生物发生
EV的生物发生始于细胞内体系统内。与MV和AB不同,外泌体不是直接从质膜释放,而是由多泡体 (MVB) 膜向内出芽产生。MVBs被称为晚期分类内体(LEs),在早期内体成熟为LEs的过程中发生内体膜内陷,导致管腔内囊泡(ILVs)的形成。该过程导致一些细胞质成分被ILV吞噬并封闭,其中大部分通过MVB与质膜融合释放到细胞外,部分被转运至溶酶体降解。这些释放到细胞外空间的ILV被称为“外泌体”。 2010年,Sai Kiang Lim团队首次证明了间充质干细胞通过分泌外泌体的治疗作用。
随后,他们证实MSC-Exos也来源于内体,富含GM1神经节苷脂,表现出高内化活性。进一步的研究一致表明,MSC-Exos与Alix、Tsg101、CD9、CD63 或CD81等其他细胞来源的外泌体具有相似的生物标志物。
间充质干细胞外泌体作为药物载体的生物学优势
源自人类细胞的EV具有显着的生物相容性、低毒性和最小的免疫原性,特别是从自体来源获得时。尤其是 MSC-Exos在治疗各种疾病方面引起了极大关注,包括骨关节炎、肿瘤和自身免疫性疾病(如IBD、SLE和SS),并报告了罕见的严重不良反应。它们的双层脂质囊泡结构和纳米级尺寸使它们能够在长距离运输过程中保持稳定并穿透组织屏障,包括关节腔。他们已经证明可以有效穿越血脑屏障(BBB)和胎盘屏障等生物屏障。 CD55和CD59等EV标记物可防止补体和凝血因子激活,确保其在体液中广泛且稳定的分布。
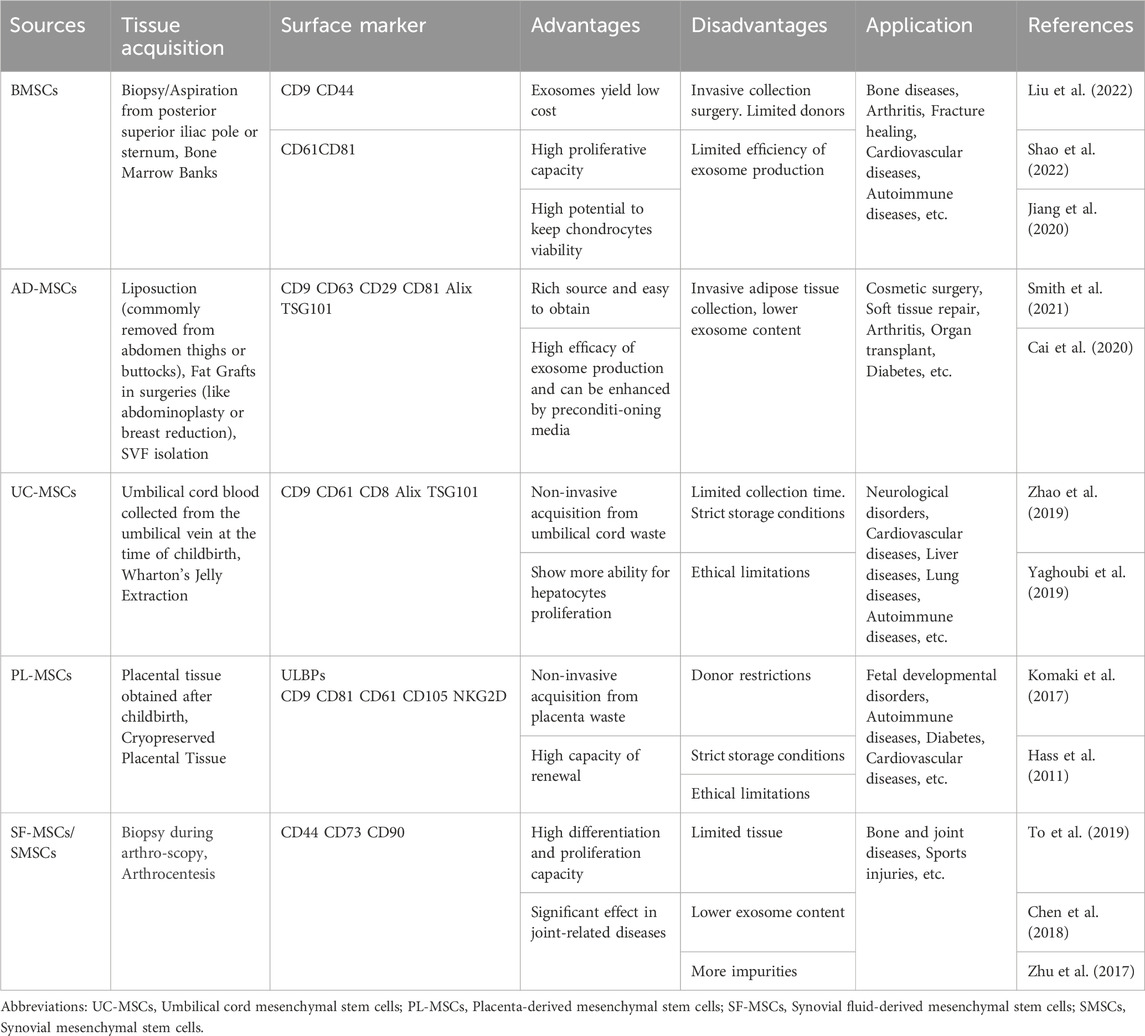
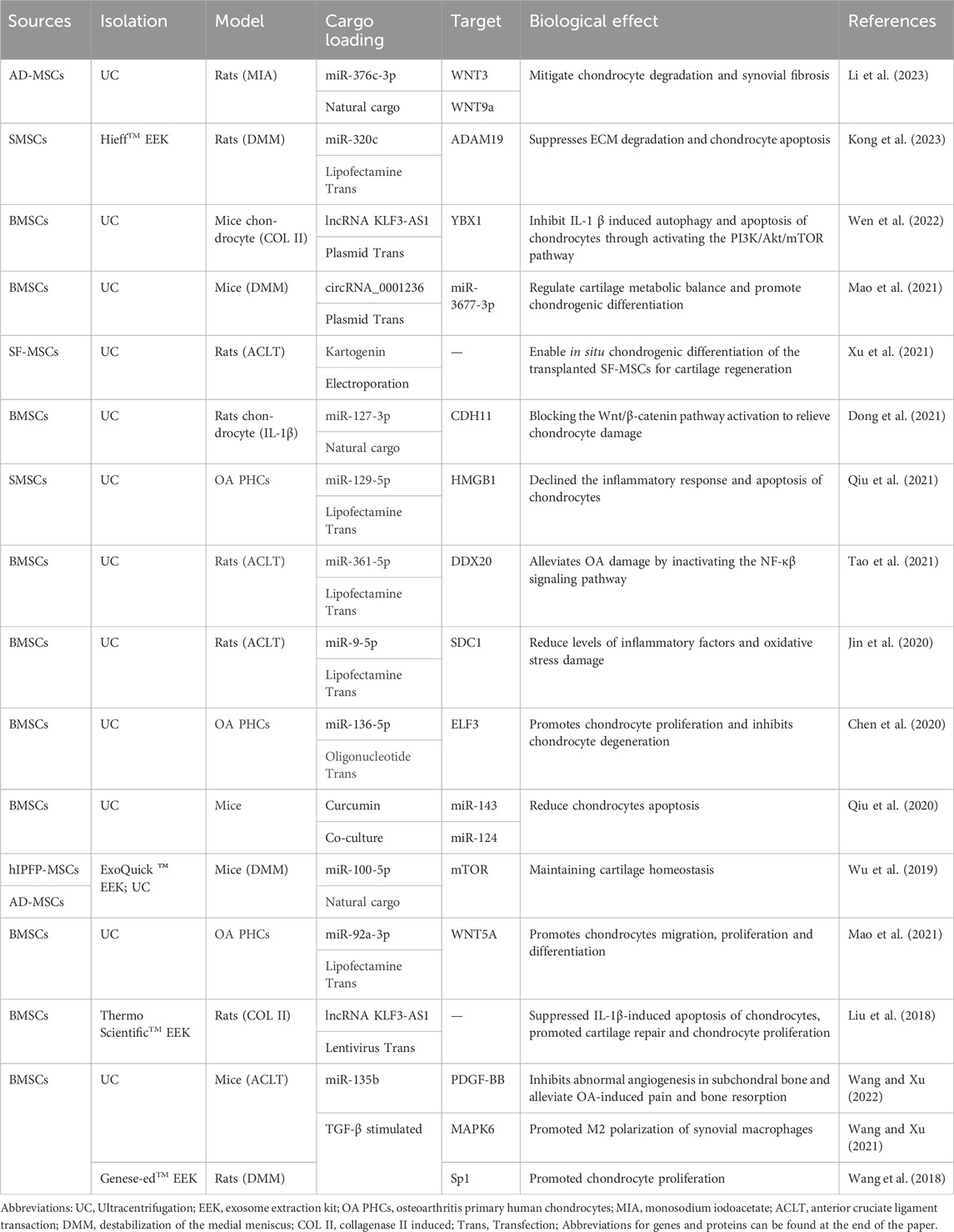
EVs内含有丰富的蛋白质、脂质和各种核酸(如miRNA、mRNA、tRNA、lncRNA和rRNA),与各种药物表现出优异的生物相容性。除了治疗之外,它们还可以携带用于疾病诊断的造影。在许多情况下,EV介导的递送构成了细胞治疗的主要机制。干细胞外泌体的一个显着优势是它们能够保留亲代细胞的某些特征。同时,不同来源的MSC-Exo的特性和应用也有所不同(表1)。
例如,免疫细胞分泌的EV具有强大的免疫调节能力,研究表明间充质干细胞衍生的EV具有免疫调节和再生功能。 MSC-Exos可以通过多种途径减少炎症介质的表达。此外,当与软骨细胞共培养时,脂肪源性间充质干细胞(AD-MSCs)和软骨细胞通过EV相互作用,促进AD-MSCs软骨形成,增加软骨细胞细胞外基质合成,并抑制细胞衰老。
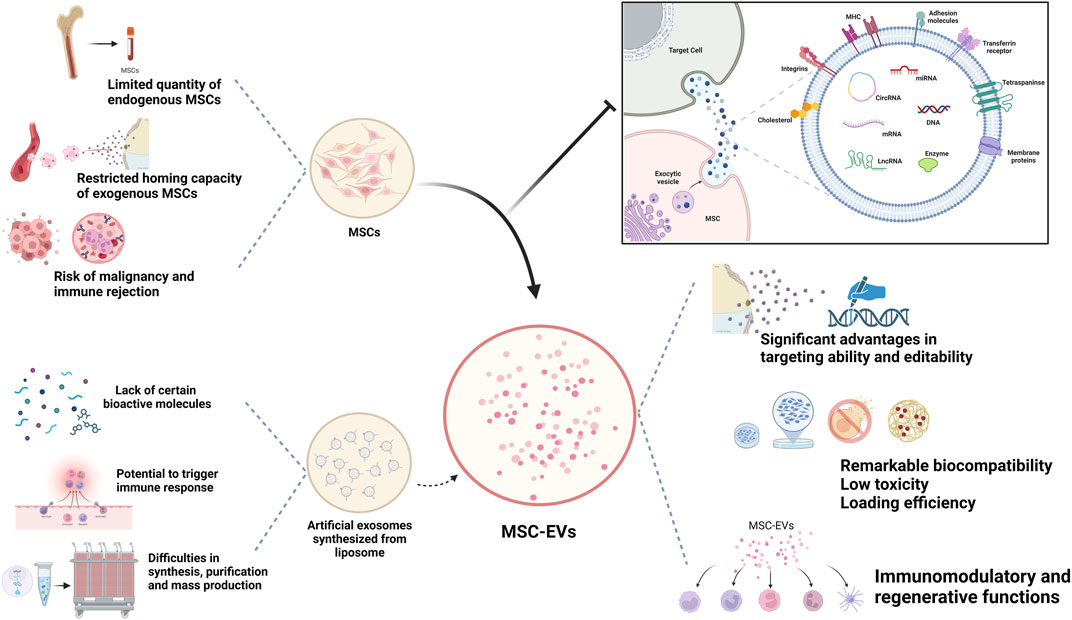
与细胞疗法不同,干细胞外泌体面临的伦理限制较少,免疫排斥和恶性肿瘤的风险也较低。同时,与需要严格条件才能维持活力的MSC相比,MSC-Exos易于维护和储存。目前,许多研究人员利用人工衍生的细胞外囊泡(例如脂质纳米颗粒和脂质体)进行研究,因为它们可以进行精确的工程设计并提供更高的重现性。然而,它们缺乏MSC-EV固有的生物复杂性,往往携带单一生物活性分子,无法完全复制MSC-Exos的生物学功能。因此,与纳米粒子、脂质体和树脂聚合物等合成药物递送系统相比,天然来源的 EV 具有卓越的治疗适用性(图1)。
间充质干细胞外泌体的制备
间充质干细胞外泌体的来源及制备
间充质干细胞可以来源于多种组织,包括脐带、脂肪组织、肌肉、牙齿组织、唾液腺、经血等。尽管它们的起源不同,但它们具有共同的特征,例如自我更新、多谱系分化潜力和免疫调节特性。国际细胞治疗学会定义了鉴定人类间充质干细胞的三个基本标准:
- 当维持在标准培养条件下时,间充质干细胞必须粘附在塑料表面。
- MSC必须表达CD105、CD73和CD90,而不表达CD45、CD34、CD14、CD11b、CD79a、CD19或HLA-DR表面标志物。
- MSC必须能够在体外分化为成骨细胞、脂肪细胞和软骨细胞。间充质干细胞可以从各种关节组织中分离出来,包括滑膜组织、半月板、韧带、脂肪垫和软骨。间充质干细胞可以从各种关节组织中分离出来,包括滑膜组织、半月板、韧带、脂肪垫和软骨。
大多数MSC来源缺乏标准化的制备程序,包括组织切碎、可选的酶消化和外植体培养。例如,成熟AD-MSC的培养通常涉及以下步骤:
首先,用PBS清洗获得的脂肪组织,以去除多余的血液成分、局部麻醉剂或关节积液。
接下来,将组织切碎,并利用胶原酶消除纤维状胶原。离心和过滤后,将分离的脂肪碎片引入培养基中进行细胞生长。这些细胞通常传代至第3代至第5代用于后续实验。
不同实验室的基础培养基、胶原酶的类型和浓度、消化时间、离心速度、持续时间和其他细节存在差异。
MSC的鉴定涉及对其表面标记物进行流式细胞术分析。不同来源的MSC的表面标志物特征不同。 AD-MSC和BMSC均在其细胞表面表达CD13、CD29、CD34、CD44、CD73、CD90、CD105、CD166、MHC I 类和 HLA-ABC。值得注意的是,AD-MSC不表达CD38、CD45、CD106、HLA-DR、DP、DQ(MHC II 类)、CD80、CD86、CD40 或 CD154。
间充质干细胞外泌体的分离鉴定
作为体内的药物载体,从间充质干细胞中高效获取纯净、安全、充足的外泌体至关重要。在实现高效大规模生产的同时,确保外泌体的纯度和均质性提出了技术挑战。已采用多种方法从MSC中分离外泌体,其中差速离心是最传统的方法。
目前普遍使用第3代至第6代MSC。当细胞汇合达到80%~90%时,更换无血清培养基,培养细胞24~48 h。所得的细胞培养上清液不仅含有外泌体,还含有多种成分,如死细胞、细胞碎片、微泡和凋亡小体。采用超速离心根据大小和密度分离外泌体,然后使用透射电子显微镜 (TEM) 进行鉴定。差速离心可产生高纯度但效率较低。相比之下,超滤由于设备要求较低、处理时间较短,更适合大规模生产。尺寸排阻色谱法 (SEC) 和离子交换色谱法 (IEC) 也能产生高纯度的外泌体。免疫分离基于针对 CD9、CD63、CD81、Alix 和热休克蛋白等表面蛋白的抗体的特异性结合,可提供高纯度,但不太适合大规模生产。然而,其高特异性可用于分离特定的外泌体亚群,具有独特的临床价值。
外泌体鉴定技术已经成熟,MSCs来源的外泌体与其他来源的外泌体在形态、分离和储存条件上没有显着差异。外泌体鉴定的基本步骤包括形态观察和表面标志物鉴定。透射电子显微镜(TEM)和扫描电子显微镜(SEM)是外泌体观察的常用技术。冷冻电子显微镜 (cryo-EM) 可提供更准确的生物信息、更高的分辨率,并允许在自然水合状态下对外泌体进行成像,无需化学固定或染色,从而保留其自然结构。冷冻电子断层扫描(Cryo-ET)是冷冻电镜的延伸,通过外泌体的三维成像提供详细的结构信息。
间充质干细胞外泌体治疗骨关节炎的研究现状
间充质干细胞治疗骨关节炎的潜力
MSCs已被证明具有在体内和体外分化成软骨细胞的潜力。如前所述,OA软骨损伤后,内源性(来自细胞周基质或循环)或外源性MSC被募集到损伤部位,在那里它们部分地进行软骨分化,促进软骨再生。 MSC-Exos影响MSC归巢并促进软骨分化。
- 严康等人利用MSC-Exo传递circRNA-0001236,发现它通过miR-3677-3p/Sox9轴增强MSC软骨形成,从而抑制软骨降解。然而,内源性MSC的数量有限,外源性MSC的归巢能力也受到限制。仅仅依靠间充质干细胞软骨形成会产生次优的结果。虽然MSC-Exos不能直接增加MSC的数量,但它们可以通过替代途径增强软骨修复。
- 陶舒等人采用miRNA-210过表达BMSCs-Exos,通过NF-kβ途径显着减少LPS诱导的软骨损伤。 AD-MSCs-Exos将miR-100-5p递送至软骨细胞,通过抑制mTOR途径显着增强细胞自噬,从而减少软骨损伤。动物实验证明了步态的显着改善。
关节腔内的炎症会加速OA的进展,通常先于放射学表现,并与临床疼痛显着相关。因此,控制早期OA炎症对于减缓其进展和改善症状至关重要。间充质干细胞调节关节内的各种免疫细胞。研究人员将AD-MSCs置于炎症刺激TNF-α和IFN-γ下,发现血管内皮生长因子和成纤维细胞生长因子基因表达增加,而促炎因子TNFA和PTGS2基因表达减少,表明AD-MSCs可以减轻炎症通过炎症环境中的旁分泌作用。鉴于MSC-Exosomes优异的递送能力和丰富的生物学功能,其作为治疗OA的药物递送系统的潜力是巨大的,相关模型的研究也日益成熟(图2)。
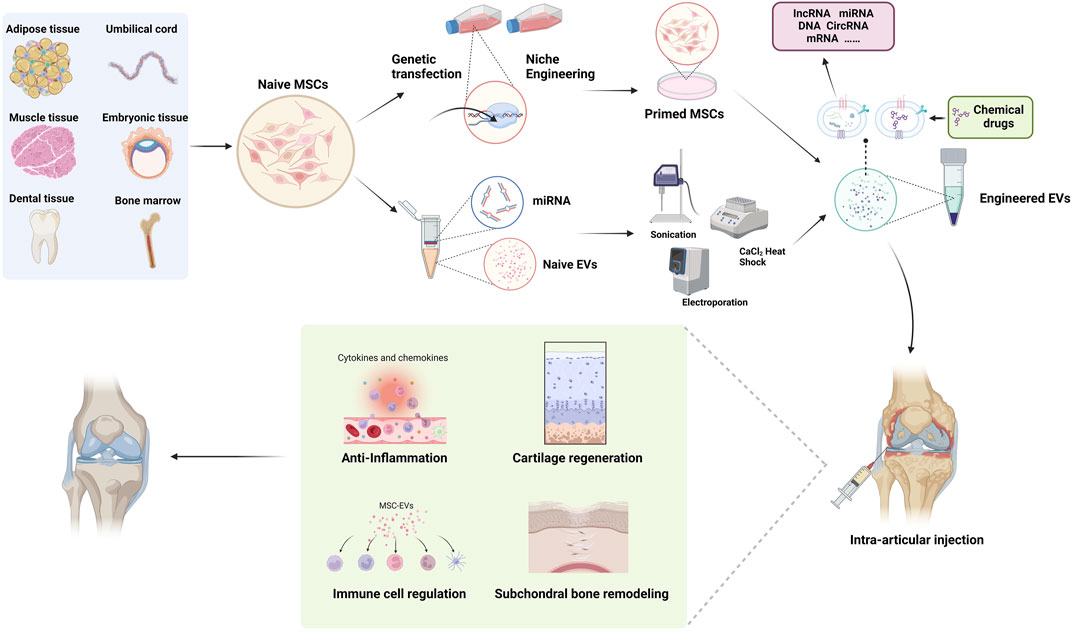
基于间充质干细胞外泌体的给药系统在骨关节炎治疗中的应用
使用MSC-Exos的无细胞疗法的研究落后于MSC疗法。目前,基于MSC-Exos的靶向给药系统(DDS)的开发还处于早期阶段,主要局限于体外或动物实验。我们总结了过去5年的代表性研究(表2)。最常用的 MSC-Exo递送涉及各种microRNA。多种microRNA已被证明可传递至关节内的软骨细胞或免疫细胞,通过促进软骨形成、抑制细胞凋亡和免疫调节来改善OA预后。
Liang等利用CAP标记的外泌体,其特点是延长关节保留时间、有限的体内扩散以及将 miR-140递送至深层软骨区域的能力。这种递送有效地抑制了软骨降解酶,从而减轻了大鼠模型中骨关节炎的进展(图3)。
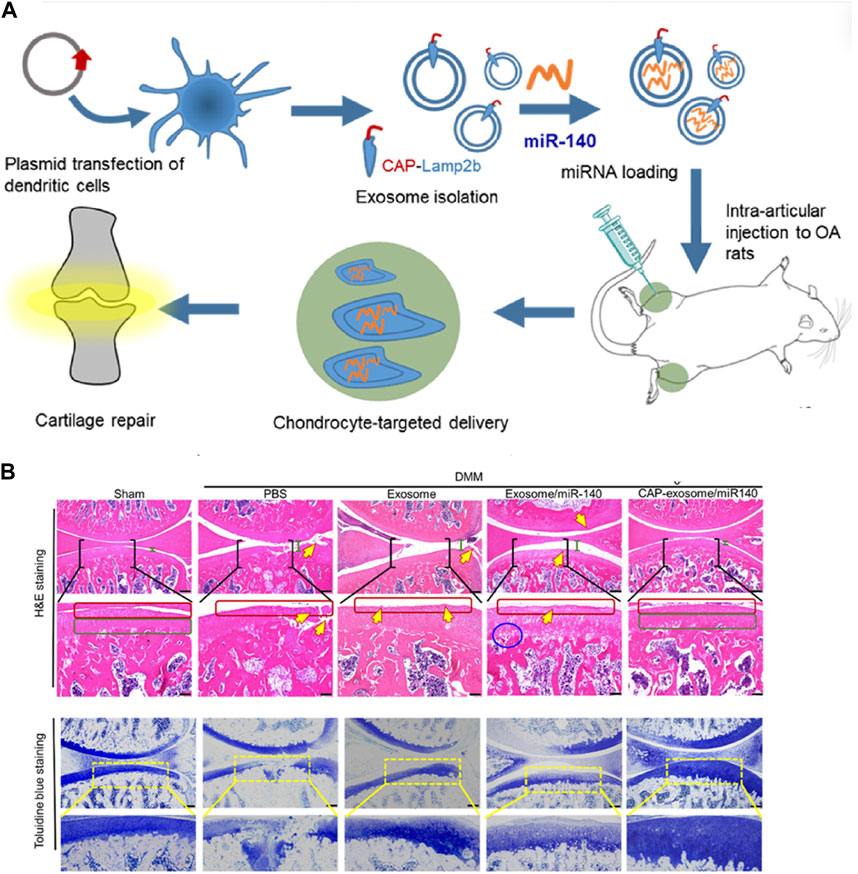
- (A)外泌体表面工程示意图,用于将miR-140靶向递送至软骨细胞以进行 OA 治疗。
- (B)用CAP-外泌体/miR-140或外泌体/miR-140制剂治疗的DMM大鼠软骨的组织学评估:软骨组织的染色图像。
截至2023年9月,美国国立卫生研究院 (NIH) 数据库中列出了238项间充质干细胞治疗骨关节炎的注册临床试验。 MSC治疗的安全性和有效性已得到很大程度上验证。
然而,只有一项与MSC-Exos相关的注册临床试验(NCT05060107),由Espinoza F于2021年10月发起。该研究旨在评估通过膝关节内注射输送的同种异体间充质基质细胞外泌体的安全性。患有轻度至中度骨关节炎症状的患者。他们计划招募10名患者参加这项1期试验,随访期长达12个月。不过,实验结果尚未公布。
结论与展望
由于对软骨造成不可修复的损伤,目前骨关节炎的非手术治疗方法并不是很有效,这是一个巨大的挑战。随着再生医学的进步,细胞疗法,特别是涉及间充质干细胞的细胞疗法,得到了广泛的研究。这些研究在各种临床前试验中显示出有希望的结果。使用MSC-Exos治疗骨关节炎不仅克服了与细胞疗法相关的伦理限制,而且还发挥了其作为药物载体的潜力。
未来的研究还将解决关节腔内持续药物释放的需求。该方法旨在显着减少关节内注射的频率,从而降低经济成本并最大限度地减少副作用。
参考资料:Wen S, Huang X, Ma J, Zhao G, Ma T, Chen K, Huang G, Chen J, Shi J and Wang S (2024) Exosomes derived from MSC as drug system in osteoarthritis therapy. Front. Bioeng. Biotechnol. 12:1331218. doi: 10.3389/fbioe.2024.1331218
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。



 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号