概述:人类多能干细胞注册中心建立了一个使用人类多能干细胞(PSCs)作为细胞治疗起始材料的临床研究数据库。自2018年以来,我们已经观察到从人类胚胎干细胞转向人类诱导多能干细胞(iPSCs)。
然而,与其将iPSCs用于个性化药物,不如说异体方法占主导地位。大多数治疗方法针对的是眼科疾病,而转基因的iPSCs被用来生成量身定做的细胞。德国弗劳恩霍夫生物医学工程研究所(IBMT)观察到,所使用的PSCs品系、PSC衍生细胞的特征、临床前模型以及用于显示疗效和安全性的检测方法都缺乏标准化和透明度。

简介
使用人类多能干细胞(PSCs)作为起始材料的临床研究是很有前途的治疗选择。因此,在这个早期阶段,要想在这个领域取得有效的进展,就必须获得正在进行的临床研究的信息,了解细胞来源、衍生细胞作为最终产品、相关疗效和安全检测以及结果的透明度。因为这些信息很难获得,所以建立了一个专门用于使用人类PSCs作为细胞疗法起始材料的临床研究数据库。
它可以通过人类多能干细胞登记处门户网站公开访问。该临床研究数据库通过关键词搜索和人工筛选公共资源而不断更新,包括在ClinicalTrials.gov(临床试验)、世界卫生组织(WHO)维护的国际临床试验注册平台(ICTRP)和其他多个来源列出的临床研究。该数据库目前列出了109项人类多能干细胞的临床研究(图1),我们进一步分析了这些研究,重点是过去10年(2012-2022)。此外,还强调了现有信息和数据的差距,并提出了改善基于PSC的临床研究相关数据的共享和获取的措施,以提高可重复性并降低监管风险。

我们的数据证实了使用人类诱导性PSC(iPSC)的研究的强烈趋势,而人类胚胎干细胞(ESC)仍然在所有研究中的很大一部分(大约50%)中使用。虽然直到2017年的大多数研究都利用了ESC,但自2018年以来,大多数研究都是基于hiPSC衍生的产品。与前两个时期相比,2022年启动的临床研究有明显下降,这可能反映了2019年冠状病毒病(COVID-19)的影响。
人类多能干细胞的疗法中采用的源PSC系的可追溯性
人类多能干细胞注册中心(hPSCreg; https://hpscreg.eu)提供了一个可用的iPSC和ESC系的资源,并证明其身份、伦理来源和生物特性等相关信息。与其临床研究数据库一起,hPSCreg提供了一个连接PSC系和临床试验信息的资源。然而,大多数使用iPSCs的临床试验没有公开披露所使用的PSC系,也没有在hPSCreg注册这些系。事实上,我们只能追踪到11个ESC系和1个iPSC系的来源PSC细胞系,其中10个和0个系分别在hPSCreg注册。
有哪些国家在多能干细胞领域进行临床研究
这些研究只在14个国家进行,在过去5年中,只有3个新加入的国家(德国、伊朗和瑞典)主持试验。这说明在这一领域发展和启动临床研究需要大量的时间和财政及其他资源,包括合格的人员、物流考虑和用于临床的细胞系的可用性。先行国家与进行最多细胞和基因治疗研究的国家重叠,这也显示了向发展中地区的延迟传播。
临床研究的发起人是负责研究的启动、管理和/或财务支持的法人实体。每个临床试验发起人的名称是ICTRP临床试验注册管理标准中的必需数据元素,适用于希望加入ICTRP注册网络的临床试验注册管理机构(国际临床试验注册管理标准v.3.0;瑞士日内瓦,WHO,2018年;许可证CCBY-NC-SA3.0IGO(政府间组织))。
在大多数情况下(109项研究中的102项),可以从临床研究注册记录中确定赞助者。在过去5年内,自2010年第一项PSC衍生的细胞治疗研究开始以来,行业赞助了更多的临床研究(图2)。在过去的5年里,工业界赞助的研究与之前的时间段(2010-2017年)相比几乎翻了一番,而学术界或政府赞助的试验在同一时间段几乎增加了三倍。

各国之间存在明显差异。在美国,行业赞助的试验数量超过学术/政府赞助的试验(分别为32项和9项),甚至在2018年之前就具有很强的代表性,而中国和日本仅在过去5年内才开始有行业赞助的试验,并且由于强大的国家资助计划,他们的大部分试验仍然主要由学术/政府赞助(袁等,2012;‘江之泽,2022年;李2022)。



只有少数临床试验(美国、日本和中国有5项)是研究者发起的试验。大型制药公司不是赞助研究的主要参与者;在世界范围内,绝大多数 (70%) 的行业赞助试验是由较小的生物技术公司进行的。
人类多能干细胞疗法的细胞类型及其目标适应症
在过去十年中,用于治疗的PSC衍生细胞类型的数量已从3种增加到22种细胞类型,涵盖44种目标适应症/疾病。
近10年来最常被关注的治疗细胞类型是视网膜色素上皮细胞,该类型的PSC衍生物已在22项临床试验中用于治疗退行性眼病(图3)。
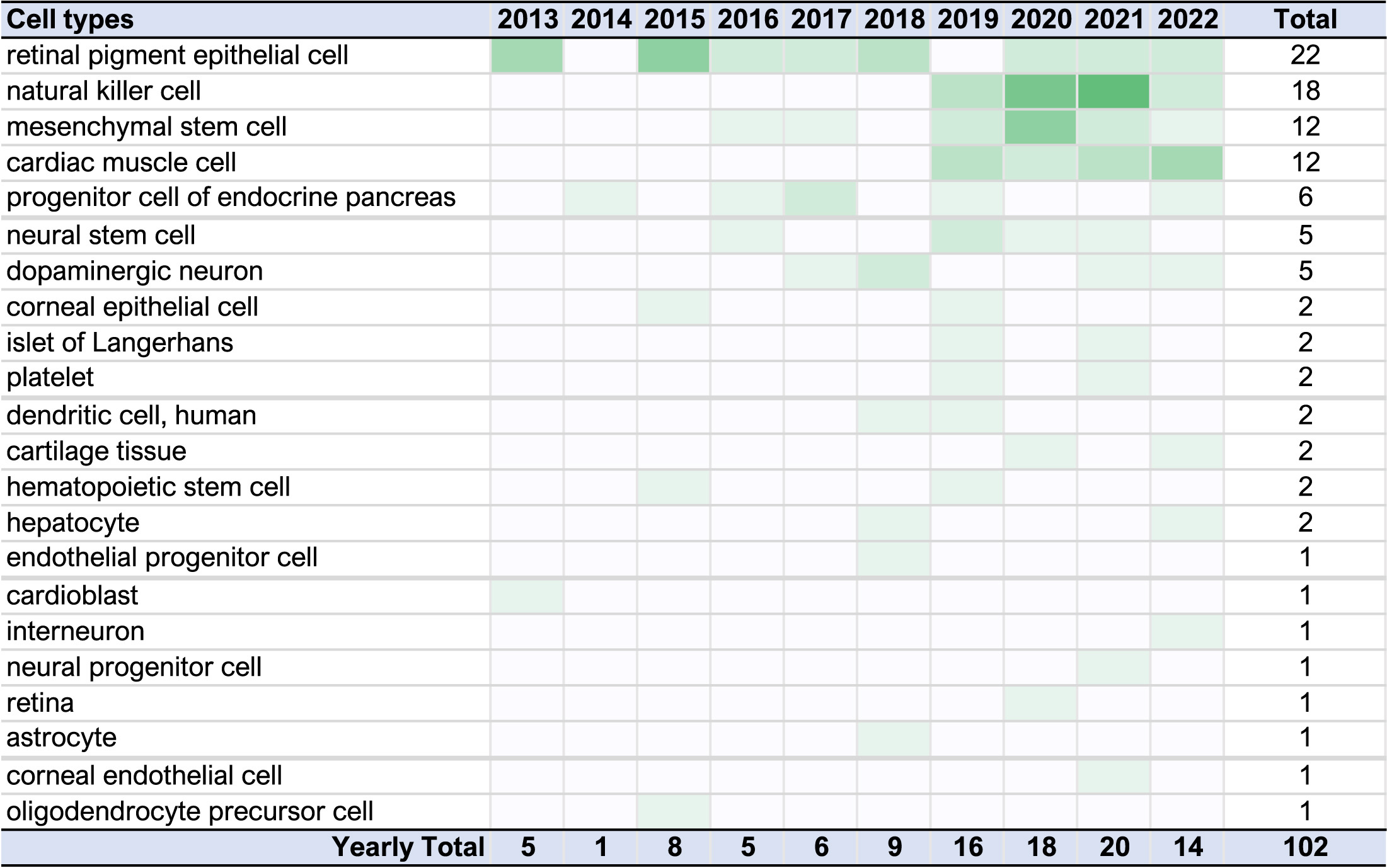
排在第二位的是自然杀伤 (NK) 细胞样衍生物,涉及18项临床研究,所有这些研究都是在过去5年内开始的。这些NK研究中超过75%是由一家公司发起的。嵌合抗原受体 (CAR)-T细胞的工程特异性赋予这些疗法靶向液体或实体肿瘤的能力。组织特异性干细胞 (TSC) 或间充质干细胞样细胞和心肌细胞样细胞用于每种细胞类型的12项研究中。
由于天然TSC细胞疗法的免疫调节特性,PSC衍生的TSC产品在PSC治疗领域正在经历一种复兴,并且适用于多种疾病靶点。心肌细胞样细胞主要用于治疗心力衰竭。其余细胞类型的每种细胞类型的适应症少于三种,其中包括用于脊髓损伤或帕金森病的神经元细胞类型、用于1型糖尿病的胰腺细胞和用于β-地中海贫血的造血干细胞,仅举几例。
使用单一细胞类型的研究的多样性也反映了同一细胞产品的不同临床研究阶段(例如后续试验或与其他既定药物联合进行的试验)或细胞对细胞变性是一种疾病的临床应用公分母。另一个重要的附加考虑因素是对任何已开发用于将细胞产品输送到患者体内适当部位的医疗设备进行临床测试。例如,正在为细胞产品OPC1 ( clinicaltrials.gov : NCT02302157)寻求一种将少突胶质细胞祖细胞递送至脊髓的移植递送系统。
人类多能干细胞疗法的疾病目标已适度扩大。2011-2017年期间启动的30项临床研究中有16项(~53%)针对眼病,而在2018年至2022年间启动的研究中,78项研究中有66项(~85%)针对其他疾病。眼病临床研究周期为2至7年,到2022年将完成15项研究;然而,已发表的数据尚不允许对结果进行荟萃分析。在hPSCreg临床研究数据库中记录的109项临床研究中,只有一小部分有相关的科学出版物。
总共有18项研究的31篇链接出版物 ( www.hpscreg.eu/browse/trials)。对于这31篇出版物,5篇包括临床前工作,1篇仅报告临床前数据,5篇包括制造方案和细胞质量评估参数,30篇报告临床研究设计和结果。关于临床研究终止、撤回或失败的报告不会发表,不幸的是,只有少数案例会记录在公共登记处。可以假设发表结果的那17项研究已经完成,因此,在记录的109项临床研究中,目前最多有93项处于活动状态。
109项研究中的90项研究持续时间(按研究开始和研究之间的时间定义)可用,并且在1到19年之间变化(中位数,7年;平均,6.5年)。从开始到完成的时间范围可以作为后续持续时间的替代指标。研究持续时间、国家监管框架、研究开始的年份或疾病类别之间没有发现相关性。
结论
人类多能干细胞的细胞临床研究的数量在过去5年中迅速增加。在接下来的十年里,随着大型制药公司寻求获得小公司的专业知识以进入细胞治疗领域,我们预计会在行业内看到更多的战略合作。与此同时,较小的公司通过许可或合作协议相互结成战略联盟。
该领域的并购也可能会增加;示例包括Fujifilm/Cellular Dynamics International (2015)、Bayer/Blue Rock Therapeutics (2019)、Catalent/RheinCell Therapeutics (2021) 和Pluristyx/panCELLa/Implant Therapeutics (2022)。我们期待更多的创新,例如针对移植输送设备和低免疫基因编辑系的临床研究。
自体应用程序可能成为已建立应用程序的标准,并依赖于降低成本的动态最终占主导地位。随着临床研究的预期增长,数据可访问性和临床研究所有方面(从原始材料到结果)的可比性的提高,再加上报告标准的一致应用,将促进全球层面的协调。这种标准化将有助于显着减少每个赞助商必须承担的监管和财务负担,并可能加速这些新疗法的可接受性。
只有监管机构、资助者和临床研究人员共同努力,通过共享开发这些疗法所需的关键数据,使基于细胞的疗法开发过程更加透明,才能充分发挥细胞疗法在世界各地的潜力。
参考资料:DOI:https://doi.org/10.1016/j.stemcr.2023.03.005
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信