干细胞的研究及其在临床实践中的应用代表了现代科学中最令人兴奋的领域之一。由于其特殊性质,干细胞提供了恢复受损组织和受损器官功能的可能性。胚胎起源的多能细胞以及重新编程的成体细胞具有最大的再生潜力,但也具有最大的肿瘤发展和自身免疫反应的风险。此外,胚胎细胞的使用在伦理上是不可接受的,因为这意味着胚胎的破坏。这篇文章分析了多能干细胞的潜力,同时也分析了科学家目前面临的局限和挑战。
自从加拿大科学家Ernest McCulloch和James Till在1960年代初期发现造血细胞能够治愈血液疾病以来,对干细胞应用的科学但普遍的兴趣稳步增长。
干细胞是人体内的特定细胞,能够分裂和分化成其他类型的细胞,形成新的组织并恢复受损的功能。干细胞的发现给许多目前无法治愈的疾病带来了最终治愈的希望。
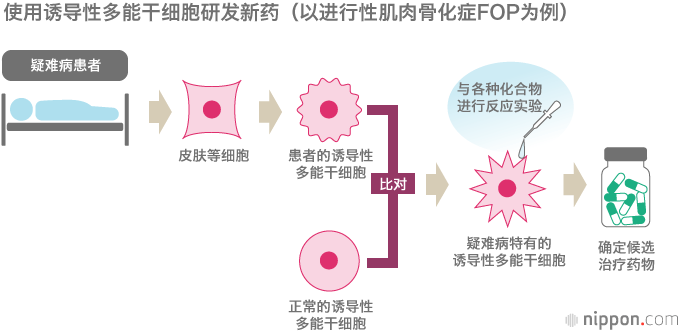
大量的科学论文为关于干细胞的性质及其功能的新知识做出了贡献,但同时也提出了许多有待解答的问题。第一个争议与术语本身有关。苏联科学家Alexander Friedenstein分离出在实验室条件下将细胞祖细胞呈递给成纤维细胞和其他中胚层折叠细胞的细胞[1]。Caplan将这些细胞命名为“间充质干细胞”[2],但25年后,同一位作者提出了其他名称“Medicinal Signaling Cells”[3]。
重命名的主要原因是采用了干细胞旁分泌作用的假说,而不是在受损组织部位直接转化为“新细胞”。
这种先进的知识激发了人们对干细胞的真正潜力、其作用的局限性以及科学面临的挑战的思考。
干细胞治疗的潜力
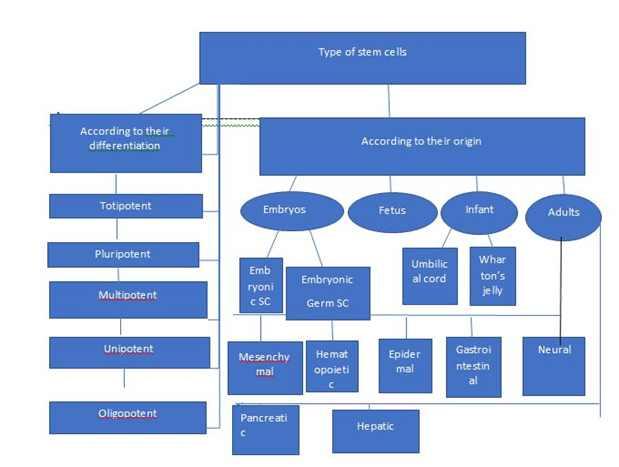
干细胞是未分化的细胞,在某些情况下可以分化成所有类型的细胞。这使它们最终能够再生受损组织并恢复身体的功能[4]它们可以按不同的方式分类(图1)。
胚胎细胞、婴儿细胞和成体细胞被认为具有治疗效率。最近,与胚胎细胞具有相似特性的重编程成体细胞引起了人们的关注。它们被命名为诱导多能干细胞 (iPSC)。
人类胚胎干细胞 (hESC)
由于它们的多能特性,胚胎来源的细胞可能具有最大的治疗潜力。然而,它们的使用是被禁止的,因为分离细胞需要破坏胚胎,此外,还存在排斥和恶性肿瘤的风险[5]。
1998年Thompson小组首次从囊胚内层获得胚胎干细胞[6,7]。他们使用体外受精卵来获得细胞。这些多能细胞具有自我更新和增殖到所有胚层的特性。它们可以分化成200多种源自内胚层、外胚层和中胚层的细胞类型 [8,9]。
临床前研究提供了有希望的结果。动物实验证实,胚胎干细胞移植导致少突胶质细胞祖细胞的形成和脊髓损伤后运动功能的恢复[10]。2015年报道了hESCs在治疗年龄相关性黄斑变性和Stargardt黄斑营养不良方面的成功临床应用。在22个月后的两项前瞻性研究中,与对照组相比,大多数患者的视力有所改善。没有报告明显的不良反应[11]。
与胚胎干细胞应用相关的伦理困境仍然是激烈讨论的主题,不仅涉及科学家,还涉及立法者、宗教权威和政治家。试图通过体外受精 (IVF) 使用胚胎来克服该问题。然而,胚胎是否是未来人类的道德困境,即使是在体外产生的,仍然是争论的主题,并且在不同国家有不同的对待。
诱导多能干细胞 (iPSC)
考虑到上述挑战,科学家们的研究旨在对成体细胞进行重新编程,使其具有与胚胎细胞相似的特性,但没有伦理影响或潜在的健康风险。
2006 年,日本科学家Takahashi和Yamanaka通过赋予胚胎细胞特性,成功地对小鼠细胞成纤维细胞进行了重新编程。他们通过添加四个多能性相关基因(即所谓的 Yamanaka 因子)实现了这一点:Oct3/4、SOX2、c-Myc和Klf4。这些细胞被命名为诱导多能细胞 (iPSC) [12]。类似的结果在人类身上得到了复制。与此同时,另一组科学家(Thomson’s group)宣布利用不同的因子发明了人类iPSC[13]。
诱导多能干细胞的主要优势在于它们可以维持多能性而不会产生伦理后果。它们可用于受损组织的再生,也可用于分析各种疾病的分子变化,以及药理物质的毒性和其他性质的检验。
可以通过对任何体细胞进行重新编程来获得iPSC。整个过程可以分为3个阶段:
– 细胞的分离和培养,
– 转染了转录因子的细胞,
– 细胞及其扩增分析 (14)(图2)。
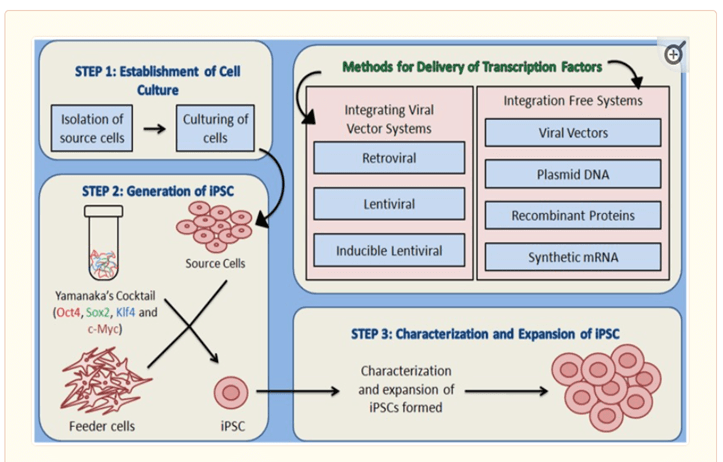
(1)培养的建立:培养源细胞以进一步用作宿主细胞以递送重编程蛋白。
(2) 然后用 Yamanaka 鸡尾酒中的四种因子转染培养的源细胞,并在合适的培养基条件下在为宿主细胞提供营养并负责形成细胞外基质的饲养层上孵育。可以使用两种类型的方法将重编程因子递送到体细胞中——整合病毒载体系统和非整合方法。
(3) iPSCs形成后,通过不同的形态学和理化分析表征,随后是iPSCs的扩增。
可以通过两种方式将转录因子引入体细胞:通过整合病毒载体系统和非整合系统。集成系统涉及使用通过载体整合到体细胞基因组中的逆转录病毒和扁豆病毒[15]。非整合法涉及使用“非整合物质”,如腺病毒和仙台病毒、质粒DNA、RNA和蛋白质[14]。
经证实,用 OCT4、SOX2、KLF4 和 MYC 因子修饰的小鼠成纤维细胞显示出增殖为胶质细胞和神经祖细胞的趋势,当注入胚胎皮层时,这些祖细胞迁移并分化为神经胶质细胞和神经元[16]。
iPSC已在动物研究中用于治疗帕金森病[17]、血小板缺乏症[18]、脊髓损伤[19]、黄斑变性[20]和许多其他病症。
2014年在日本理化学研究所对黄斑变性患者进行了首次临床应用[21]。在第一位患者中记录到疾病在没有显着不良或免疫反应的情况下减慢。然而,出于安全原因,该研究在另一名患者中停止[22]。从那时起,已经批准了多项使用同种异体来源的iPSC的临床研究。大多数正在进行的研究在日本获得国家批准。这些研究与帕金森病、AMD、严重心力衰竭、再生障碍性贫血、脊髓损伤和角膜干细胞缺乏症有关[23]。
iPSCs的应用面临诸多挑战。使用完整的病毒系统最初产生了不到1%的iPSC。还发现慢病毒和逆转录病毒的插入作为整合过程的一部分会导致诱变[24]。两个Yamanaka因子c-Myc和Klf4具有多能性但也具有致癌特性[25]。另一种 Yamanaka 因子 Oct3/4 在胰腺癌、胃癌、口腔鳞状细胞癌、精原细胞瘤和膀胱癌等不同癌症的发生发展中也发挥作用[26-28]。
这些问题中的大多数通过实施“非整合”因素得到解决[29,30]。使用自体来源制备iPSC,虽然在免疫学上是安全的,但过程非常缓慢且耗时,无法广泛应用[31]。由于供体的HLA系统与受体的不相容性,同种异体来源易发生自身免疫反应。使用免疫抑制剂后会出现不良反应[32]。存在通过将供体的HLA与大多数人群相匹配来形成细胞库来解决该问题的尝试。
结论
对多能干细胞应用的兴趣不断增加,越来越多的已发表研究证实了这一点[33]。
重新编程成体细胞的可能性开辟了再生受损组织和恢复功能的前景,而不会产生伦理影响。临床前研究和初步临床结果令人鼓舞,尽管仍然存在许多阻碍更频繁临床应用的挑战。
它期望选择最合适的细胞、开发新技术以及更好地了解多能细胞与宿主环境的相互作用将有助于更安全的应用和更好的治疗结果。
参考资料:
- Friedenstein AJ, Piatetzky S, Petrakova KV. (1966) Osteogenesis in transplants of bone marrow cells. J Embryol. Exp Morphol. 16:381-90.
- Caplan AI. (1991) Mesenchymal stem cells. J Orthop Res. 9(5):641-50.
- Caplan AI. (2017) Mesenchymal Stem Cells: Time to Change the Name! Stem Cells Translational Medicine. Stem Cells Transl Med. 6(6):1445-51.
- Biehl JK, Russell B. (2009) Introduction to Stem Cell Therapy. J Cardiovasc Nurse. 24(2):98-105.
- Zhang M, Cheng L,Yuyan J. (2016) Aneuploid embryonic stem cells exhibit impaired differentiation and increased neoplastic potential. EMBO J. 35(21):2285-300.
- Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, et al. (1998) Embryonic stem cell lines derived from human blastocysts. Science. 282(5391):1145-7.
- Keller. (2005) Embryonic stem cell differentiation: emergence of a new era in biology and medicine. Genes Dev. 19:1129-55.
- Itskovitz-Eldor J, Schuldiner M, Karsenti D, Eden A, Yanuka O, et al. (2000) Differentiation of human embryonic stem cells into embryoid bodies compromising the three embryonic germ layers. Mol Med. 6(2):88-95.
- Wray J, Hartmann Ch. (2012) WNTing embryonic stem cells. Trends Cell Biol. 22(3):159-68.
- Keirstead HS, Nistor G, Bernal G. (2005) Human Embryonic Stem, Cell-Derived Oligodendrocyte Progenitor Cell Transplants Remyelinate and Restore Locomotion after Spinal Cord Injury. J Neurosci. 25(19):4694-705.
- Schwartz DS, Regillo C, Lam LB, Eliott D, Rosenfeld PJ, et al. (2015) Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385(9967):509-16.
- Takahashi K, Yamanaka S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126:663-76.
- Yu J, Vodyanik AM, Smuga-Otto K, Bourget JA, Frane JL, et al. (2007). Induced pluripotent stem cell lines derived from human somatic cells. Science 318,1917-20.
- Vimal SK, Manish K, Neeraj K, Abhishek S, Ramesh C. (2015) Induced pluripotent stem cells: applications in regenerative medicine, disease modeling, and drug discovery. Front Cell Dev Biol. 3:2.
- Takahashi K, Ichisaka T, Yamanaka S. (2006). Identification of genes involved in tumor-like properties of embryonic stem cells. Methods Mol Biol. 329:449-58.
- Wernig M Zhao JP, Pruszak J, Hedlund E, Fu D, Soldner ,F et al. (2008) Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson’s disease. Proc Natl Acad Sci. 105(15):5856–61.
- Kriks S, Shim JW, Piao J, Ganat YM, Wakeman DR, et al. (2011) Dopamine neuronsderived from human ES cells efficiently engraft in animal models of Parkinson’s disease. Nature 480:547-51.
- Takayama N, Nishimura S, Nakamura S, Shimizu T, Ohnishi R, et al. (2010). Transient activation of c-MYC expression is critical for efficient platelet generation from human induced pluripotent stem cells. J Exp Med. 207(13):2817-830.
- Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, et al. (2011). Grafted human induced, pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice. Proc Natl Acad Sci USA. 108:16825-830.
- Okamoto S, Takahashi M. (2011) Induction of retinal pigment epithelial cells from monkey iPS cells. Invest Ophthalmol Vis Sci. 52(12):8785-879.
- Eguizabal C, Aran B, Chuva de Sousa Lopes SM, Geens M, Heindryckx B, Panula S, et al. (2019) Two decades of embryonic stem cells: A historical overview. Human Reprod Open. 2019(1):1-17.
- Mandai M, Watanabe A, Kurimoto Y, Hirami Y, Morinaga C, Daimon T, et al. (2017) Autologous induced stem-cell-derived retinal cells for macular degeneration. The New England J Med. 376:1038-46.
- https://www.intechopen.com/books/8026
- S Yamanaka. (2009) Elite and stochastic models for induced pluripotent stem cell generation. Nature. 460(7251):49-52.
- Klimczak M. (2015) Oncogenesis and induced pluripotency – commonalities of signalling pathways. Contemp Oncol (Pozn). 19(1A):A16-A21.
- Wasik AM, Grabarek J, Pantovic A, Pobuda AC, Asgari HR, et al. (2014) Reprogramming and carcinogenesis-parallels and distinctions. Int Rev Cell Mol Biol. 308:167-203.
- Koide H. (2014) Embryonic stem cells and oncogenes. Pluripotent Stem Cell Biology-Advances in Mechanisms, Methods and Models. InTech. 2014:41–61.
- Lu Y, Zhu H, Shan H, Lu J, Chang X, et al. (2013) Knockdown of Oct4 and Nanog expression inhibits the stemness of pancreatic cancer cells. Cancer Lett. 240:113–23.
- Fusaki N, Ban H, Nishiyama A, Saeki K, Hasegawa M. (2009) Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proc Jpn Acad Ser B Phys Biol Sci. 85(8):348-36.
- Warren L. (2010) Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell 7(5):618 -30.
- Bravery CA. (2015) Do human leukocyte antigen-typed cellular therapeutics based on induced pluripotent stem cells make commercial sense? Stem Cells Dev. 24(1):1-10.
- Malat G, Culkin C. (2016) The ABCs of Immunosuppression: A Primer for Primary Care Physicians. Med Clin N Am. 100:505-18.
- Kobold S, Guhr A, Mah N. (2020) A Manually Curated Database on Clinical Studies Involving Cell Products Derived from Human Pluripotent Stem Cells. Stem Cell Reports. 15(2): 546-55.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信