肝病在世界范围内普遍存在。当它到达末期时,死亡率上升到50%或更多。尽管肝移植已成为终末期肝病最有效的治疗方法,但其应用受到供体肝脏稀缺的限制。缺乏可接受的供体器官意味着患者在等待合适的肝脏时处于高风险之中。在这种情况下,细胞疗法已成为一种很有前途的治疗方法。
大多数情况,移植细胞可以替代宿主肝细胞并重塑肝脏微环境。例如,来自供体肝脏的肝细胞或干细胞在肝脏中定植和增殖,可以替代宿主肝细胞,恢复肝功能。其他候选细胞疗法,如巨噬细胞和间充质干细胞,可以重塑肝脏微环境,从而修复受损的肝脏。
近年来,细胞疗法已从动物研究转向早期人体研究。近日,浙江中医药大学第四临床医学院等在《Stem Cell Research&Therapy》国际期刊中发表了一篇《终末期肝病的细胞治疗:替代与重塑》的文献综述。
在这篇综述中,我们将讨论终末期肝病治疗中的干细胞疗法,尤其关注用于细胞移植的各种细胞类型,并阐明所涉及的过程。此外,我们还将总结细胞疗法的实际障碍并提供潜在的解决方案。
细胞疗法的多种细胞来源和治疗部位
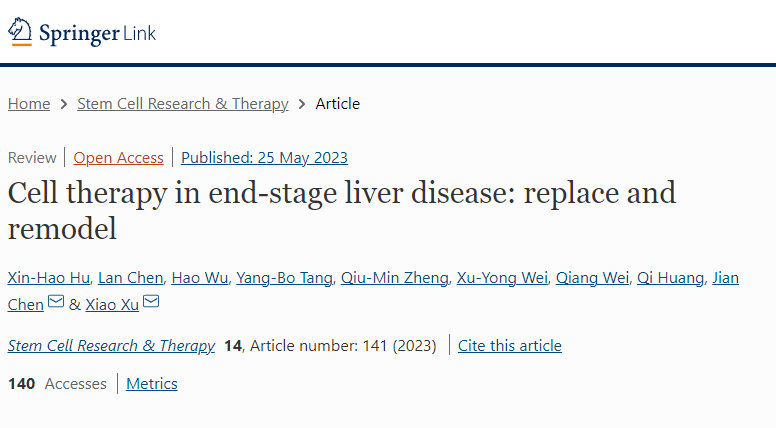
肝小叶基本呈六边形,门脉三联体(门静脉、胆管和肝动脉)位于小叶的外围,中央静脉位于中间。肝细胞作为肝脏的原代实质细胞,承担着肝脏的大部分生理功能,并由于肝脏强大的再生能力而维持一定的肝体比。因此,可以将肝细胞植入肝脏以促进肝脏再生,这意味着移植的肝细胞会增殖并取代宿主肝细胞(图1)。
然而,肝细胞的获取和保存是一个普遍的问题。为了获得更多的肝细胞,一些团队逐渐开始使用干细胞或具有干细胞特性的可转分化或分化为肝细胞的细胞进行细胞移植(图1)。例如,胆管上皮细胞(BEC) 可以转分化为肝细胞,我们认为这是由于细胞可塑性。标记BEC表明,在严重肝损伤的情况下,这些细胞可以转化为肝细胞,暗示它们可能是可移植细胞的来源。
在最近的研究中,源自胆管细胞的肝外类器官已被证明可以在移植后保持人胆管树内的可塑性,并且可以修复人肝内胆管。在进一步的研究中,多能干细胞(PSCs)和胎肝祖细胞可能在体外分化为肝细胞或肝细胞样细胞用于细胞治疗,这将在后面详细描述(图1)。
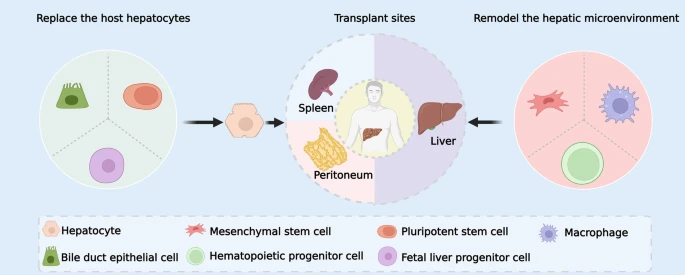
细胞移植前,胆管上皮细胞、多能干细胞和胎肝祖细胞必须在体外分化为肝细胞。移植后,这些细胞在肝脏内增殖并取代宿主肝细胞。此外,间充质干细胞、巨噬细胞和造血祖细胞可以重塑肝脏微环境。肝脏、脾脏和腹膜都是细胞移植的潜在部位
除了替换宿主肝细胞和在肝脏内扩张外,移植细胞还可以重塑肝脏微环境(图1)。例如,移植细胞可以对终末期肝病发挥免疫调节、抗炎和抗纤维化作用。
此外,已经表明,骨髓移植细胞在放弃转分化时,可能会刺激肝细胞增殖并恢复肝功能。总之,移植细胞可以通过更换宿主肝细胞和重塑肝脏微环境来治疗肝脏疾病(图1)。
更换受损的肝脏
肝细胞
已显示成体肝细胞在体内扩张,类似于造血干细胞。根据新英格兰医学杂志的病例报告,一名患有I型Crigler-Najjar综合征和严重未结合高胆红素血症的10岁女孩通过门静脉输注7.5×109个肝细胞得到有效治疗,并且对患者的治疗益处持续长达11个月,并允许过渡到原位肝移植(OLT)。此外,肝细胞移植 (HT) 已被用于治疗患有肝脏代谢异常的儿科患者,并且正在进行多项调查以提高细胞的可用性和安全性。
另一方面,肝细胞悬液可以安全地进入门静脉,证明细胞疗法比OLT 具有更低的手术风险。斯特罗姆等人。已显示肝细胞脾动脉输注对慢性终末期肝病患者的安全性和治疗效果。
急性肝衰竭 (ALF) 是一种罕见的急性疾病,死亡率很高。细胞疗法更适合具有典型肝脏结构的ALF患者。在几个研究中心,已经进行了临床肝细胞移植研究。
来自印度的7名患者接受了来自26-34周大未出生婴儿的胎儿肝细胞腹膜输注。结果显示,HT患者的总生存率比对照组高10%。比里尔等描述了五名接受脾内HT治疗的ALF患者。移植后48小时,5名患者中的3名在HT后的脑病评分、血氨水平、凝血酶原时间和总生存率方面均有显着改善。
总的来说,肝细胞移植的应用显示出对终末期肝病的巨大治疗潜力。然而,这种方法有局限性。主要挑战之一是肝细胞的可用性和植入效率有限,以及制造困难。这些障碍包括难以从供体肝脏中分离出高质量细胞、在维持活力的同时冷冻保存肝细胞的机制限制、移植肝细胞的植入和增殖水平低,以及与细胞输送相关的问题。
胎肝祖细胞
在体外,胎肝祖细胞(FLPs)可以分化成肝细胞(图1)。已经表明,来自人类和其他灵长类动物的胎儿肝细胞可能在免疫缺陷小鼠的肝脏中增殖和成熟,重新填充10%的器官。此外,已经表明FLP可以分化为功能性人内皮细胞,并且在移植后九个月内未观察到肿瘤发展。
多能干细胞
多能干细胞 (PSC) 在细胞移植前需要分化为肝细胞,被认为是HT的替代细胞来源(图1)。为了区分胚胎干细胞 (ESC) 和诱导多能干细胞 (iPSC ) ,已开发出多种技术。ESC来源于受精后4-5天在人类囊胚细胞簇中形成的多能干细胞。由于对ESC的研究由来已久,一些方案利用细胞发育信号来促进ESC向肝细胞样细胞 (HLC) 的分化。此外,ESC移植后的免疫排斥和ESC获取的伦理问题也是不可避免的问题。2013年,许多研究小组使用核移植从患者的体细胞中有效地创建了ESC,尽管该过程在技术上仍具有挑战性。
类器官
类器官的应用越来越引起研究人员的兴趣。“类器官”被定义为从干细胞或成体细胞生长的三维 (3D) 结构。与二维(2D)细胞系相比,类器官具有器官结构和遗传稳定性的优势。合适的类器官被认为是可用细胞疗法的重要来源。之前的研究已经成功地从Lgr5+细胞和iPSCs 构建了肝脏类器官,可用于治疗小鼠肝功能衰竭。
武部等据报道,移植后,肝脏类器官可以重建功能性血管,使小鼠免受药物性肝损伤 。福布斯等。使用由纯化的人胆管上皮细胞 (hBEC) 构建的类器官,在胆道疾病小鼠模型中挽救了胆管结构和功能。剑桥大学的一项研究发现,胆管细胞类器官在人体肝脏移植后可以修复胆管损伤。
总之,类器官在细胞移植中显示出巨大的前景。未来的研究可以应用肝脏/胆管细胞类器官治疗终末期肝病,并提高扩大的肝脏供体库中扩大标准供体的质量。
重塑肝脏微环境
抗炎和免疫调节作用:除了替换宿主肝细胞外,移植细胞还通过重塑肝脏微环境来促进LR。重要因素之一是移植细胞的免疫调节作用。间充质干细胞 (MSC) 因其分离、生长和保存简单而常用于临床。MSC最初是在骨髓中分离出来的,也可以从脐带和脂肪组织中获得(图2)。
MSCs能够通过分泌抗炎因子来抑制免疫细胞的增殖和促炎细胞因子的分泌。MSCs通过分泌前列腺素E2 (PGE2)、受激基因/蛋白6和吲哚胺2,3-双加氧酶 (IDO) 来改善巨噬细胞的抗炎作用。促炎细胞因子,如IL-1β和IL-6,也被MSCs抑制。此外,MSCs以IDO依赖性方式抑制抗体的产生和分泌以及活化B淋巴细胞的增殖。总之,可以利用MSCs的抗炎和免疫调节作用来促进肝脏再生。
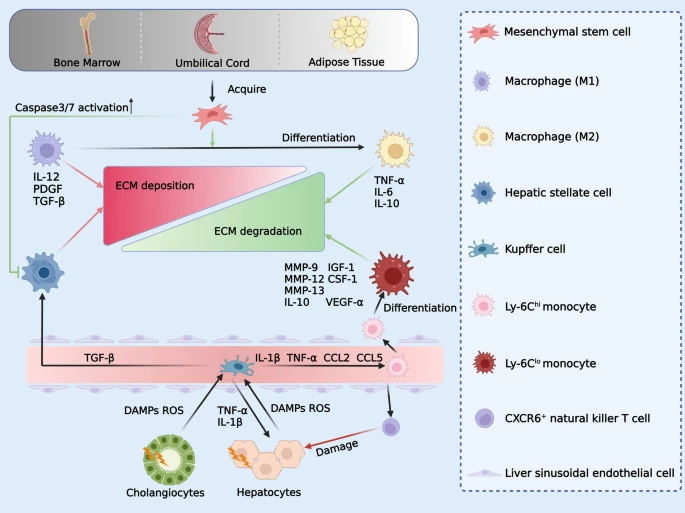
从骨髓、脐带和脂肪组织中获得的MSCs可以通过促进巨噬细胞的极化子从M1到M2并抑制HSCs来减少ECM沉积。
抗纤维化:纤维化是终末期肝病的主要表现之一。MSCs和巨噬细胞能有效缓解肝纤维化和ECM沉积。MSC的主要功能是在LR期间释放多种营养因子以抑制肝星状细胞 (HSC) 活化和ECM形成,从而通过T细胞、B细胞和巨噬细胞的免疫调节减少纤维化、细胞凋亡和炎症(图2)。
Lin等人的另一项工作。表明MSCs可能会阻止激活的HSCs的增殖并促进它们的死亡。某些临床试验已经证实了间充质干细胞移植对慢性肝病患者的治疗益处。
根据Lin等人的一项随机对照试验,外周输注同种异体骨髓间充质干细胞对于HBV相关ACLF患者是安全实用的。通过增强肝功能和降低严重感染的风险,这种治疗显着增加了24周生存期。此外,已经表明,通过肝动脉输注施用的MSC可显着降低患者的肝纤维化,并导致Child–Pugh评分显着改善。然而,相对于一次移植,肝纤维化在两次MSC移植后并未恶化。由于这些原因,间充质干细胞被认为是细胞治疗的潜在细胞来源。
肝脏巨噬细胞是慢性肝损伤病理生理学中的关键细胞之一,最近被强调为可能的抗纤维化靶点。巨噬细胞在组织损伤后会发生显着的表型和功能变化,并且对于组织恢复的启动、维持和解决阶段至关重要。
最近,研究了肝硬化患者对自体巨噬细胞输注治疗的反应。福布斯等对9名肝硬化患者进行自体巨噬细胞治疗,MELD评分为10至16 (ISRCTN 10,368,050)。一年之内,所有人都还活着并且没有进行移植,达到了研究的安全性和可行性的主要目标。这项工作为肝硬化和其他纤维化疾病的细胞治疗提供了理论基础。
总之,间充质干细胞和巨噬细胞对肝脏的再生至关重要,可作为细胞疗法的来源。
组织修复和再生
细胞疗法的另一个功能是促进组织修复和再生。造血祖细胞在这个过程中起主要作用。
目前的假设认为,造血祖细胞治疗受损肝脏后的治疗改善主要是通过供体和宿主细胞之间的旁分泌信号刺激内源性祖细胞介导的,后者提供细胞因子和生长因子。
在最近的临床研究中,接受造血祖细胞移植的酒精性肝硬化患者取得了持久的治疗效果。E.Yannaki等人证明G-CSF在急性肝损伤模型中加速恢复并提高存活率。在一项大型随机对照临床研究中,G-CSF与通过门静脉输注自体造血祖细胞的组合显着提高了存活率和肝功能(通过Child–Pugh评分和肝脏生物化学测量)。然而,接受G-CSF或输注G-CSF和自体CD133+细胞的肝硬化患者没有明显的效果。这些临床研究的多样性可能源于不同的输液方案、输液技术和剂量。
优化细胞疗法的操作
细胞输送
肝脏高度血管化;因此,移植细胞可以通过几种不同的途径给药,其中门静脉或肝动脉是最常见的(图3)。移植的细胞应被输送到肝窦,在那里它们随后需要与肝实质整合。最常见的临床技术是通过门静脉进行细胞输注。成人有三种选择:肝内脾静脉支流穿刺、肝内门静脉支流穿刺和经颈静脉通过肝静脉系统的肝内门静脉分流术。
对于新生儿,通过脐静脉插管进入。对于年龄较大的儿童,可以使用腹腔镜或最小解剖手术或切开法将中央静脉插管置入门静脉支架中。
根据细胞的大小,肝细胞穿过窦状静脉,暂时阻塞门静脉周围血管区域,随后通过血管通透性恢复正常血流。然而,所有这些治疗方案都有出血的风险,特别是对于经常有门脉高压、侧支循环形成和凝血功能障碍的肝病患者。
因此,有两种可能的解决方案来管理这个问题:
(1) 连续多普勒超声监测以确保门静脉压力不超过12mmHg和
(2)移植细胞的肝动脉给药(图3)。
与门静脉方法相反,肝动脉通常用作内部放射治疗和动脉化疗栓塞的导管,并且可以作为一种更有效的细胞输送方式。其他研究提出了替代策略,例如肝硬化患者的脾内细胞输注和ALF患者的腹膜递送方法 。这些策略的优点是它们允许功能性肝脏恢复,同时防止肝脏免疫排斥。
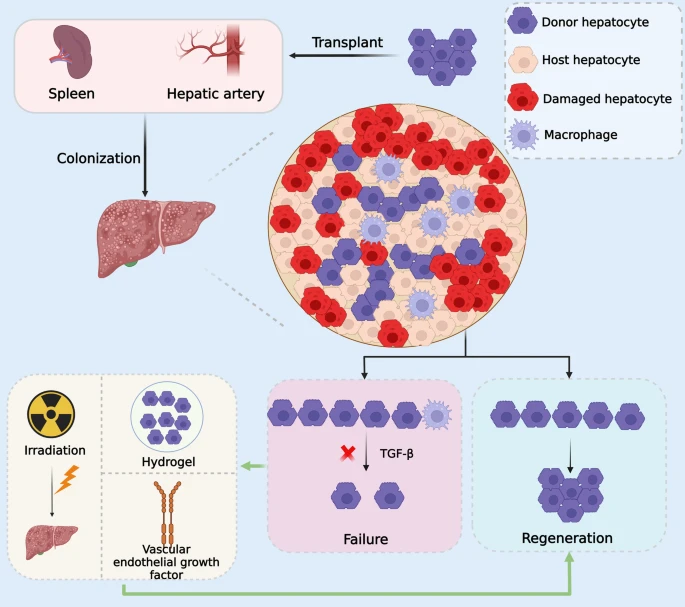
图3:肝细胞移植的优化。通过肝动脉或脾脏进行的肝细胞移植可能会导致更好的定植。
并且肝细胞到达肝脏后可能被巨噬细胞排斥。巨噬细胞吞噬供体肝细胞并分泌TGF-β以诱导衰老。在这种情况下,巨噬细胞可以通过将供体肝细胞包裹在水凝胶中来避免吞噬作用。另一方面,可以通过照射肝脏或注射血管上皮生长因子来增强供体肝细胞的增殖优势
细胞恢复和增殖
移植后供体细胞的活性和增殖能力对细胞治疗的有效性起着重要作用。肝细胞保存一直是一个严重的问题。冷冻保存显着损害肝细胞,减少ATP生成并下调整合素-β1和E-钙粘蛋白。同时,使用细胞凋亡抑制剂和胱硫醚抑制剂改善了肝细胞的活性和功能。
结论和观点
随着全球肝移植需求的增长,需要更多的研究来弥合供体肝脏和等待名单患者之间的差距,并改善肝移植受者的长期预后。在过去的几十年里,细胞疗法取得了显着进步,证明了干细胞治疗肝病的有效性和安全性。在将其用于临床试验之前,必须解决许多挑战,包括从供体肝脏中分离出高质量的细胞,增强细胞植入以减少免疫反应,以及改善植入和长期结果。
此外,干细胞或具有干细胞特性的细胞可用于解决与肝细胞获取相关的挑战。源自iPSC的HLC和各种细胞来源的类器官(iPSC、祖细胞、胆管细胞)为细胞治疗提供了足够的细胞来源。此外,iPSC和类器官在体内移植中始终具有更高的生存能力和效率。具有遗传稳定性和高度可扩展特性的类器官可能是治疗终末期肝病的一种有前途的策略。肝脏中的不同细胞具有更换和重塑肝脏微环境的作用;
因此,将多种细胞治疗结合起来可能是细胞治疗的未来趋势。细胞疗法最显着的优势是可以高度灵活地选择最佳细胞和移植部位进行治疗,以满足患者的需求。
参考资料:Hu, XH., Chen, L., Wu, H. et al. Cell therapy in end-stage liver disease: replace and remodel. Stem Cell Res Ther 14, 141 (2023). https://doi.org/10.1186/s13287-023-03370-z
免责说明:本文 仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。



 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号