强调:
- 细胞疗法一直是医学中一种有前途的再生方法。
- 干细胞和终末分化细胞都用于细胞治疗。
- 细胞疗法可以使用自体和同种异体细胞进行。
- 几乎所有疾病/病症都可以通过细胞疗法来治疗。
概述
细胞疗法作为一种有前途的再生医学方法,已成为治疗甚至治愈各种疾病和病症的有前途且有效的策略。一般来说,细胞治疗中使用两种类型的细胞,第一种是干细胞,另一种是完全分化的细胞。
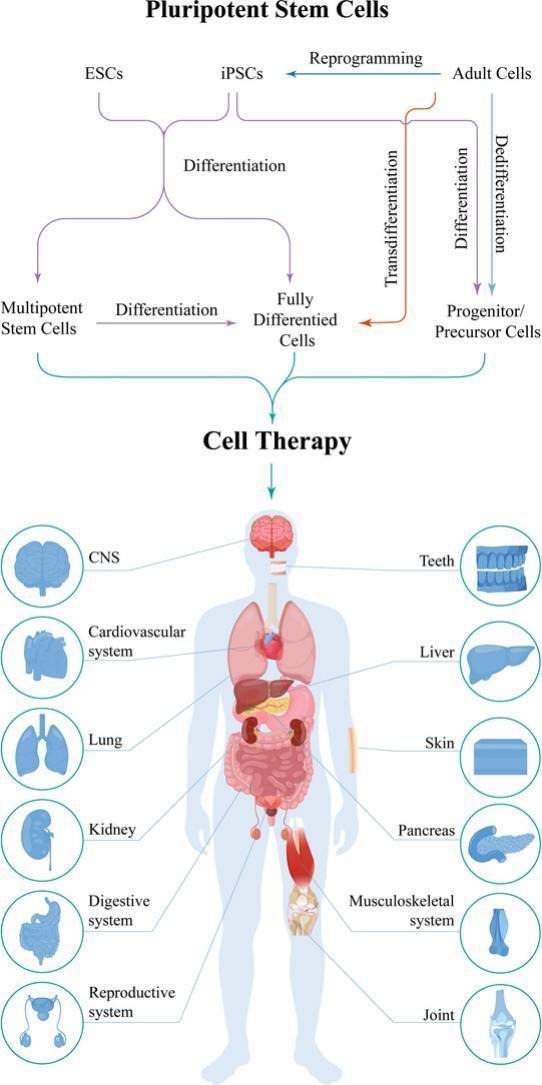
最初,体内的所有细胞都源自干细胞。根据干细胞的能力、效能和分化潜力,有四种类型:全能(产生所有体细胞加上围产期组织)、多能(产生所有体细胞)、多能(产生多种类型的细胞)和单能(产生特定类型的细胞)。所有非全能干细胞均可用于细胞治疗,具体取决于其效力和/或疾病状态/状况。成体完全分化细胞是另一种用于细胞治疗的细胞类型,它是从成体组织中分离出来的或在干细胞分化后获得的。然后,这些细胞可以被移植回患者体内,以替换受损或故障的细胞,促进组织修复,或增强目标器官的整体功能。随着生物学和医学科学和知识的不断增加,已经开发出不同类型的技术来获得用于治疗方法的有效细胞。在这项研究中,回顾了所有细胞类型(包括干细胞和完全分化细胞)的潜力和机会。
介绍
再生医学是一种新的多学科技术,采用不同的策略,包括细胞治疗、组织工程和基因治疗,来修复、再生和替换细胞、组织或器官,以实现或建立正常功能。基于细胞的疗法是再生医学中一种很有前景的方法,可以治愈或治疗多种疾病和病症。
细胞治疗根据细胞类型可分为两种类型:未分化干细胞治疗和完全分化细胞治疗。干细胞是一种非特化细胞,可以自我更新(分裂自我繁殖)并分化成更特化的细胞。在生命中,干细胞理论上从第一个受精细胞(受精卵)到死亡一直存在。根据潜能和分化潜能,干细胞分为全能干细胞、多能干细胞、专能干细胞、寡能干细胞和单能干细胞。从受精卵到桑葚胚的细胞被鉴定为具有最高效力的全能细胞,能够产生所有类型的胚胎细胞以及围产期组织。多能(ESC;胚胎干细胞,iPSC;诱导多能干细胞),多能(hAEC;羊膜上皮细胞,MSC;间充质干细胞,HSC;造血干细胞,NSC;神经干细胞,EpiSC;表皮干细胞),单能细胞(VSPC;血管干细胞/祖细胞)表现出高增殖潜力和分化能力,但与全能细胞相比,其效力较低。
随着再生医学和干细胞技术的发展,引入了一些特定术语,包括转分化、去分化、重编程和可塑性。转分化,也称为直接细胞重编程,是指将分化的(成熟)细胞直接转化为另一个成熟细胞,而不通过多能中间状态转变。去分化是在同一谱系内完全分化的细胞逆向发展为低分化阶段的过程。重编程代表了成熟分化细胞向具有多能样特征的细胞的转化过程。干细胞可塑性是指干细胞改变其身份和状态的假定能力,或者换句话说,获得除原始组织之外的细胞类型的命运。
完全或完全分化的细胞是另一种可用于细胞治疗的细胞类型,是从成体组织或干细胞终末分化后获得的。具有高细胞治疗潜力的不同类型的分化成体细胞包括黑素细胞、心肌细胞、成纤维细胞、肝细胞、软骨细胞、内皮细胞、胰岛细胞、红细胞、血小板、树突状细胞、巨噬细胞、淋巴细胞(肿瘤浸润淋巴细胞、自然杀伤细胞) NK)细胞、调节性T细胞、嵌合抗原受体 (CAR) T细胞、γδT细胞。
本研究旨在收集和回顾基于干细胞和完全分化细胞的不同类型治疗方法的研究和当前科学知识,这些方法已被引入再生医学中作为有前途且合适的生物药物。据我们所知,我们的研究是第一个总结回顾了所有细胞类型(包括干细胞和完全分化细胞)的潜力和应用。
干细胞
什么是人类胚胎干细胞?
人胚胎干细胞(hESC)是从囊胚期人类胚胎的内细胞团中获得的多能细胞,能够在培养中长期增殖而不分化。已知它们产生三个初级胚层(外胚层、中胚层和内胚层)的细胞和组织(图1)。尽管ESC具有治愈和治疗大多数疾病和病症的独特潜力,但ESC的应用由于一些限制而受到限制或禁止,包括伦理和宗教问题、免疫不耐受以及畸胎瘤形成的风险。
什么是诱导多能干细胞?
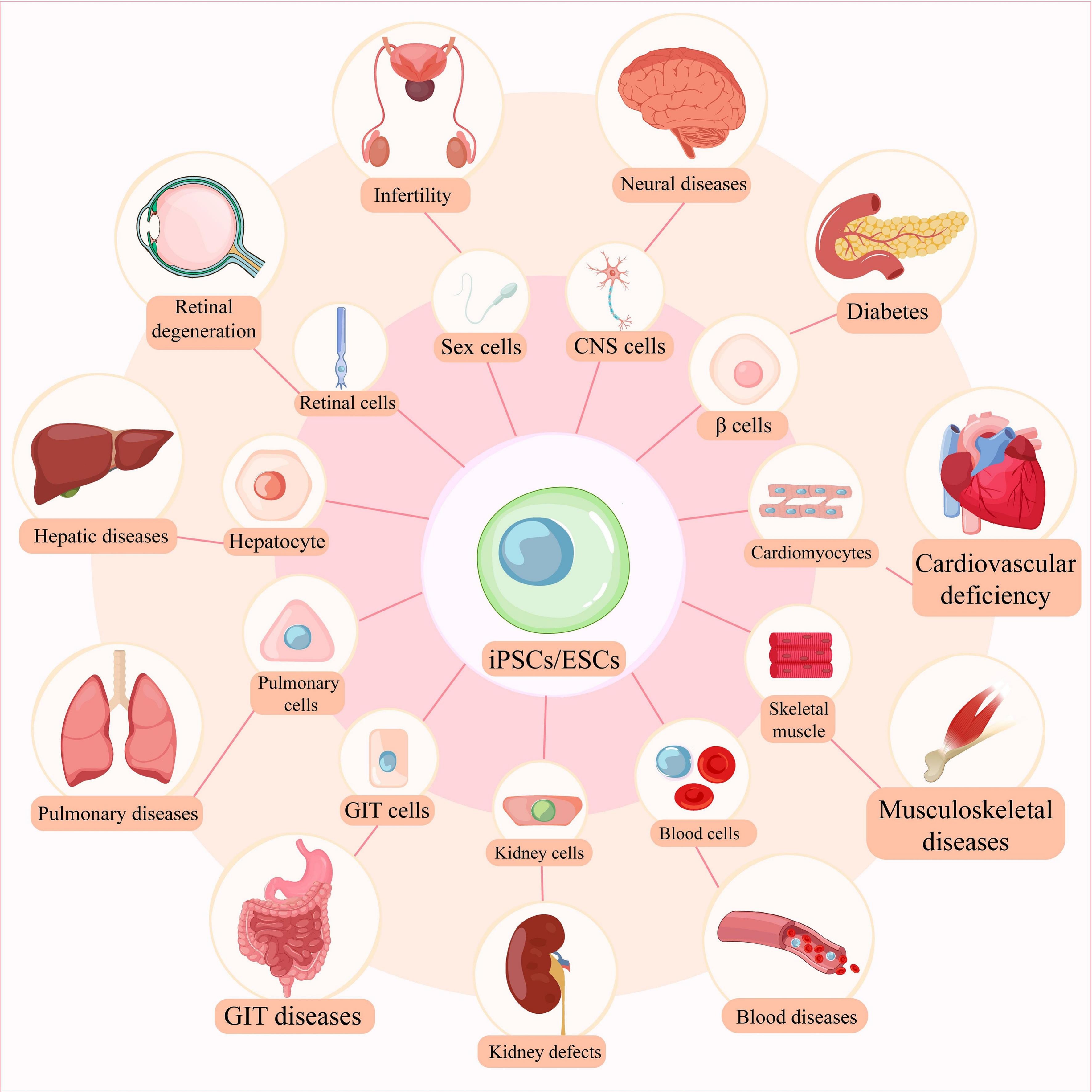
诱导多能干细胞(iPSC)是实验室产生的源自成体细胞的多能细胞,具有成体细胞和干细胞在治疗应用方面的生物学优势。 iPSC 是通过转导和异位表达特定转录因子(例如 Oct3/4、Sox2、c-Myc、Nanog和Klf4)而产生的人造细胞。由于其无限的增殖能力,类似于ESC,并且绕过伦理和免疫原性问题,这些细胞可以在各种疾病中具有广泛的应用(图1)。
iPSC可广泛用于移植到患有各种损伤或退行性疾病的患者中,包括神经疾病、视网膜变性、肝脏疾病、糖尿病、心血管缺陷、肺部疾病,皮肤病,移植物抗宿主病(GvHD)和组织移植,不孕症、血液疾病、肾脏缺陷、胃肠道疾病、肌肉骨骼系统,以及最近的COVID-19。值得注意的是,畸胎瘤形成是iPSC给药的一个重大风险。因此,iPSC衍生的细胞和组织不得具有致瘤性,并且所有多能细胞在移植前必须完全分化。
什么是人羊膜上皮细胞?
人羊膜上皮细胞(hAEC)是一种围产期干细胞,可以很容易地从胎盘最内层分离出来。 hAEC代表了多能(增殖和分化能力)和多能(成体干细胞样免疫调节特性)干细胞的行为,具有易于分离、数量大、无伦理问题、非免疫原性和非致瘤特性等优点。与MSC一样,hAEC基于直接细胞间接触和旁分泌机制发挥保护和再生功能,并被建议用于基于细胞和无细胞的治疗方法。
越来越多的证据表明,hAECs在组织再生和治疗免疫相关疾病和退行性疾病方面具有很高的治疗潜力,例如脑部疾病和神经系统疾病(多发性硬化症、帕金森病、脑出血、脑损伤、痉挛性脑瘫)、肺部疾病(COVID-19相关的急性呼吸窘迫综合征(ARDS)、肺纤维化、支气管瘘、支气管肺发育不良)和肝脏(肝纤维化、脂肪性肝炎、肝硬化)损伤、角膜损伤、糖尿病、急性肾衰竭、心血管疾病,包括心肌梗塞(MI) 和中风、炎症和自身免疫性疾病(全身性炎症、GVHD、自身免疫性卵巢疾病、甲状腺炎、克罗恩病、系统性红斑狼疮)、代谢性疾病(枫糖浆尿病)、伤口愈合、III期压疮愈合、骨不连骨折、跟腱损伤和生殖障碍(卵巢早衰(POF)、宫腔粘连和阿什曼综合征)。此外,hAEC的应用已被证明可以在同种异体移植之前或之后实现有益的治疗效果。
什么是间充质干细胞?
间充质干细胞(MSC)是多能基质细胞,可以更新并分化为各种细胞类型,在免疫调节、组织愈合和再生医学中发挥关键作用。在动物模型和人类临床试验中,间充质干细胞在修复各种退行性和免疫介导疾病的受损组织方面显示出有希望的结果。
MSCs可来源于多种围产期和成人组织,如骨髓、脂肪、肝脏、脾脏、滑液、皮肤、牙髓、牙龈、角膜缘、外周血和经血、胎盘、脐带血、羊水、绒毛膜和沃顿胶(图2)。作为最广泛使用的干细胞类型之一,间充质干细胞由于其广泛的可用性和易于获得、低免疫原性风险、高再生能力和免疫调节功能等优点,在各种疾病和病症中具有治疗潜力。间充质干细胞通过三种机制发挥其治疗作用:直接细胞间接触、旁分泌活性和分化。

间充质干细胞表现出归巢特性并迁移到损伤部位,它们可以分化为损伤部位的局部成分并释放有助于组织再生的分泌因子,例如细胞外囊泡、趋化因子、细胞因子和生长因子。
已经开展了许多利用间充质干细胞治疗多种疾病的临床试验,如中枢神经系统(CNS)相关损伤和神经系统疾病(多发性硬化症、脊髓损伤、中风、脑瘫、自闭症谱系障碍、肌萎缩侧索硬化症、帕金森病、阿尔茨海默病)、肺部疾病(ARDS;急性呼吸窘迫综合征、BPD;支气管肺发育不良、COPD;慢性阻塞性肺发育不良、IPF;特发性肺纤维化、COVID-19)、糖尿病、皮肤病(烧伤、伤口)、卵巢早衰、心血管疾病(心力衰竭、缺血性心肌病、非缺血性扩张型心肌病、严重缺血性心力衰竭、难治性心绞痛)、消化系统疾病、肝脏疾病、免疫系统疾病(自身免疫性难治性癫痫、系统性红斑狼疮(SLE))、移植物抗宿主病、肌肉骨骼疾病、眼部疾病和肾脏疾病(图2)。
什么是造血干细胞?
造血干细胞(HSC)是从骨髓、外周血和脐带血中分离出来的其他多能细胞。与其他干细胞类似,HSC 可以自我更新,并能够发育成所有血系和免疫细胞,包括红细胞 (RBC)、白细胞 (WBC) 和血小板。通过 HSC 的对称或不对称分裂,造血作用在整个生命过程中持续维持。
据推测,所有血液学和免疫系统疾病都有可能通过基于HSC的疗法或HSC移植 (HSCT) 得到治疗或治愈。 HSC通过(反)分化、营养因子的产生以及丢失或受损细胞群的替代来发挥治疗作用。自体和同种异体 HSC移植通常用于治疗和管理恶性和非恶性血液、自身免疫和遗传性代谢疾病。
HSC已显示出分化成许多非造血细胞的巨大潜力,例如内皮前体细胞、脑小胶质细胞和大胶质细胞、肝细胞、骨骼肌和心肌细胞。
多种血液系统恶性肿瘤,包括霍奇金淋巴瘤、非霍奇金淋巴瘤(NHL)、急慢性淋巴细胞白血病(ALL、CLL)、多发性骨髓瘤、急慢性粒细胞白血病(AML、CML)、单核细胞白血病、骨髓增生异常等。临床上采用造血干细胞移植治疗。此外,诸如乳腺癌、神经母细胞瘤、肾细胞癌、尤文氏瘤、肾母细胞瘤、视网膜母细胞瘤、骨肉瘤、生殖细胞瘤和软组织肉瘤(横纹肌肉瘤)等实体瘤已进行HSC干细胞治疗的临床研究(图3)。

尝试通过自体造血干细胞移植治疗的免疫性疾病有多发性硬化症、系统性硬化症(SSc)、克罗恩病、胰岛素依赖型糖尿病(IDD)、系统性红斑狼疮(SLE)、类风湿性关节炎和幼年特发性关节炎。
HSC显示出用于治疗血细胞疾病的独特潜力,包括原发性免疫缺陷(腺苷脱氨酶 (ADA) 缺陷的严重联合免疫缺陷、X 连锁严重联合免疫缺陷、其他遗传形式的严重联合免疫缺陷 (SCID)) ,Rag1/2),Wiskott-Aldrich综合征,慢性肉芽肿病,白细胞粘附缺陷,噬血细胞性淋巴组织细胞增多症,X连锁高IgM综合征,X连锁淋巴增殖性疾病,X连锁无丙种球蛋白血症,常见变异型免疫缺陷),血红蛋白病(镰状细胞病) 、β-地中海贫血)、储存和代谢性疾病(戈谢病和其他脂质沉积症、粘多糖沉积症(I-VII)、X连锁肾上腺脑白质营养不良、异染性脑白质营养不良、石骨病)、血红蛋白病、组织细胞增多症、严重再生障碍性贫血、先天性血细胞减少症和干细胞缺陷( Fanconi 贫血、Schwachman-Diamond 综合征、Kostmann 综合征)(图3)。
也有人提出,造血干细胞移植可以成为人类免疫缺陷病毒(HIV)疾病、中枢神经系统疾病(包括中风、创伤性脑损伤和神经退行性疾病(肌萎缩侧索硬化症(ALS))的有价值的治疗干预措施。和僵人综合症),以及肝脏损伤、心脏、胰腺和肾脏损伤。
基因工程和iPSC衍生的HSC被认为是完整HSC的有前途的替代品,用于治疗方法和再生医学。
什么是神经干细胞?
神经干细胞 (NSC) 是多能中枢神经系统干细胞,具有良好的自我更新和分化成主要中枢神经系统细胞类型(神经元、星形胶质细胞和少突胶质细胞)的能力,通过补偿神经干细胞的丢失或缺乏,在维持细胞稳态方面发挥着关键作用。内源性神经元和神经胶质细胞。基于NSC的治疗策略被认为是治疗神经退行性疾病、中风以及脑和脊髓损伤等无法治疗的神经系统疾病的一种有前途的方法。
NSC的神经退行性和神经保护活性被认为是由不同的机制介导的,例如神经营养因子的产生、免疫/炎症调节、神经元可塑性和细胞替代。NSCs在临床应用中的利用存在一些局限性,包括伦理问题、获得人类 NSCs的挑战以及与低存活率、分化和增殖相关的问题。随着新技术的发展和干细胞领域的进步,可以不受限制地从iPSC或体细胞转分化中获得足够数量和质量的NSC。
为了评估基于NSC的治疗的可靠性和有效性,已经针对中风、肌萎缩侧索硬化症 (ALS)、年龄相关性黄斑变性 (AMD)、脑瘫 (CP)、缺氧等神经系统疾病和损伤进行了多项临床试验。 -缺血性脑病(HIE)、帕金森病(PD)、进行性多发性硬化症(P-MS)和脊髓损伤(SCI)。
什么是血管干/祖细胞
血管干/祖细胞(VSPC)存在于血管中,产生血管构建、维护、修复和重塑所需的多种类型的血管细胞。 VSPC的四种主要类型是内皮祖细胞(EPC)、平滑肌祖细胞(SMPC)、周细胞和间充质干细胞(MSC),它们在血管生成和血管生成中发挥重要作用。
EPC被定义为干细胞群,具有典型克隆增殖能力并分化为成熟内皮细胞 (EC),存在于各种组织中,包括骨髓、脾脏、血管壁、脂质和胎盘。 EPC通过直接和间接的旁分泌活动显示血管再生功能,这些活动参与血管生成、动脉生成(侧支生长)和新血管生成(新毛细血管的生长)。已经进行了多项临床试验来评估 EPC在外周动脉疾病、冠状动脉疾病、扩张型心肌病、缺血性中风、难治性心绞痛、动脉粥样硬化、严重肢体缺血、肺动脉高压、糖尿病足、肝硬化、淋巴水肿、勃起功能障碍中的治疗潜力。
SMPC可以分化为成熟的血管平滑肌细胞 (SMC),这对于收缩血管、调节血管收缩和血压至关重要。骨髓、血液、血管壁、骨骼肌、肾脏和血管外基质是SMPC的主要来源。SMPC在各种条件、机械影响和生长因子刺激下可以表现出不同的表型,例如合成或增殖、炎症、成骨、内吞和其他表型。一些血管疾病的发病机制,如动脉粥样硬化、血管机械损伤和修复以及血管再狭窄,已知与SMPC有关,因为它们增殖并分化为平滑肌细胞,通过稳定动脉粥样硬化斑块和新内膜形成而导致血管再狭窄。
周细胞是基底膜内的多功能血管周围细胞,具有干细胞特性,能够产生多种细胞类型。已证明,周细胞参与分化为其他细胞类型、血管生成、维持血管结构完整性、介导炎症反应(细胞因子和趋化因子分泌)和碎片吞噬作用。周细胞因其多功能性和多能性而被引入作为一种有吸引力的治疗选择,特别是对于缺血性和血管功能障碍相关疾病。
什么是表皮干细胞
表皮干细胞(EpiSCs)主要存在于表皮,基底层和毛囊隆起处有丰富的血供。作为一个具有无限增殖潜力的细胞群,EpiSCs不断产生功能细胞来替代受损或死亡的细胞,以实现皮肤的再生、新陈代谢和伤口修复。 EpiSCs具有抗衰老潜力,可用于治疗烧伤、先天性皮肤损伤、慢性伤口、大疱性表皮松解症、白癜风、角膜缘干细胞缺乏症、脱发和尿道再生(表1) 。
表格1:各种干细胞类型在细胞治疗应用中的优点和缺点。
| 干细胞类型 | 优点) | 缺点) | 参考) |
|---|---|---|---|
| 人类胚胎干细胞(ESC) | 分化为所有三个胚层的细胞 | 伦理问题、免疫排斥可能性、畸胎瘤风险 | (Deinsberger 等人,2020;Wang 等人,2021b) |
| 诱导多能干细胞 (iPSC) | 从患者自身细胞生成,降低排斥风险,避免伦理问题,个性化医疗的潜力,适合疾病建模和药物发现 | 基因突变的可能性,畸胎瘤的风险 | (Gois Beghini 等人,2020;Rose 等人,2020;Tani 等人,2022) |
| 间充质干细胞(MSC) | 从各种组织中获得,易于分离,分化为多种细胞类型,比胚胎干细胞争议更少,免疫调节特性 | 难以在培养物中长期生长 | (Yousefi-Ahmadipour 等人,2021;Markov 等人,2021;Galderisi 等人,2022b) |
| 造血干细胞(HSC) | 应用范围广,可分化为所有血细胞,具有自体和异体移植潜力 | 供应有限、捐赠者限制、收集方法具有挑战性 | ( Mosaad, 2014 ; Xiong et al., 2017 ) |
| 神经干细胞(NSC) | 分化为神经元和神经胶质细胞 | 可用性有限、肿瘤形成风险、靶向精度有限 | (Zhang 等人,2019;Zhu 等人,2021;Gioia 等人,2020;De Gioia 和 Biella,2020;Pluchino 等人,2020) |
| 血管干/祖细胞 (VSPC) | 分化为内皮细胞和平滑肌细胞,有望应对血管修复和再生的挑战 | 分离和体外扩增具有挑战性,分化潜力有限 | (陶等人,2022;卢和李,2018) |
| 表皮干细胞 (EpiSC) | 分化为角质形成细胞和其他表皮细胞 | 可用性有限、形成肿瘤的风险、复制能力有限 | (Morgun 和 Vorotelyak,2020;Ambler 和 Määtta,2009) |
完全/彻底分化的细胞
什么是胰岛细胞
糖尿病是最常见、最复杂的疾病之一,由于癌症、传染病和其他并发症导致死亡率很高。1型糖尿病 (T1D) 和晚期2型糖尿病的特点是产生胰岛素的β细胞丧失和功能障碍,以及长期外源性胰岛素给药后严重的外周胰岛素抵抗。同种异体/自体β细胞替代疗法或胰岛移植已成为糖尿病患者充分血糖控制和预防危及生命的严重低血糖的一种有前景的方法。
然而,由于目前的一些局限性,包括尸体胰岛短缺、胰岛纯化率低、与慢性免疫抑制相关的并发症以及胰岛移植成本高昂等,需要新的胰岛移植方法。通过多能干细胞(ESC和iPSC)技术生成功能性β细胞是一种克服局限性的新型治疗方法。一些研究报道,功能性胰岛素生成细胞可以通过成熟体细胞的转分化产生,例如角质形成细胞、成纤维细胞、肌肉细胞、胰腺细胞、肝细胞、胃肠道上皮、胆囊细胞、甲状腺神经内分泌细胞和胰岛非β细胞(α和δ和γ细胞)。
什么是黑色素细胞
黑素细胞是起源于胚胎神经嵴的一组异质黑色素生成细胞,不仅存在于表皮、头发和虹膜中,还存在于内耳、神经系统和心脏中。黑素细胞执行许多重要功能,例如皮肤稳态、紫外线防护和动物外观多样化。黑素细胞的功能障碍、破坏和丧失会导致色素脱失状况和病理,例如白癜风和特发性点滴状黑色素减少症,这会降低患者的生活质量、自尊心低下并经历社会孤立。基于使用黑素细胞的细胞疗法一直是治疗色素脱失皮肤的有效治疗策略,可为患者提供出色的美容效果。
然而,表皮源性黑素细胞由于数量限制和增殖能力差而限制了其移植。其他有前途的黑素细胞生成来源,具有高治疗潜力,没有或更少的限制,包括黑素细胞干细胞和成黑细胞、真皮干细胞、毛囊干细胞、毛囊外根鞘干细胞、胚胎神经嵴干细胞、多能干细胞细胞(ESC和iPSC)和转分化体细胞。
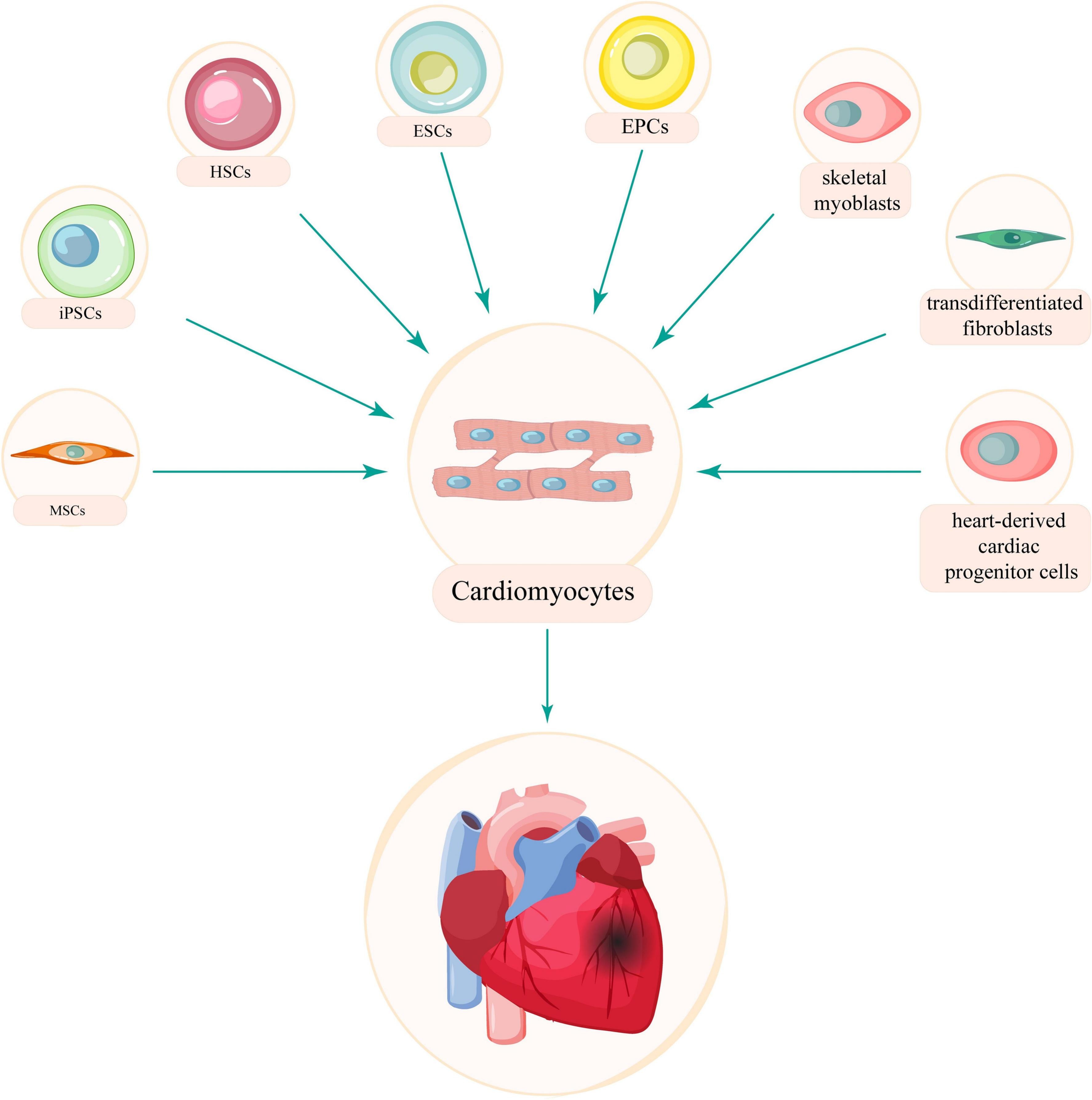
什么是心肌细胞
心脏损伤后受损的心肌细胞被纤维化疤痕组织取代,降低心脏的收缩能力,导致病理性心脏扩张、额外的心肌细胞死亡和机械功能障碍,最终导致心力衰竭。由于成人心脏的再生能力极低、供体的缺乏以及心脏移植的复杂性,恢复心肌细胞的损失是改善心脏重塑和修复的一个有希望的候选者,这可以通过刺激内源性来实现心肌细胞增殖、体细胞转分化为心肌细胞以及从多能干细胞产生心肌细胞。产生心肌细胞的主要起始细胞来源是心脏来源的心脏祖细胞、骨骼肌成肌细胞、HSC、MSC、EPC、ESC、iPSC和转分化的成纤维细胞(图4)。
什么是成纤维细胞
成纤维细胞是基质和大多数间充质组织中的非造血结构细胞,合成细胞外基质成分,包括胶原蛋白、蛋白聚糖、纤连蛋白、层粘连蛋白、糖胺聚糖、金属蛋白酶,甚至前列腺素。成纤维细胞决定器官结构,支持稳态功能和其他细胞类型的定位,并在伤口愈合、纤维化、癌症和自身免疫等病症和疾病中发挥重要作用。然而,已证明成纤维细胞具有抗炎、免疫调节和再生特性,这为基于成纤维细胞的治疗策略提供了巨大潜力。
体内和体外研究表明,成纤维细胞在治疗溃疡、皮肤疤痕、烧伤和手术伤口、隐性营养不良性大疱性表皮松解症、皱纹、美容和生物衰老、皮肤发育不良、自身免疫性T1D和牙龈吸收方面具有很高的治疗潜力。
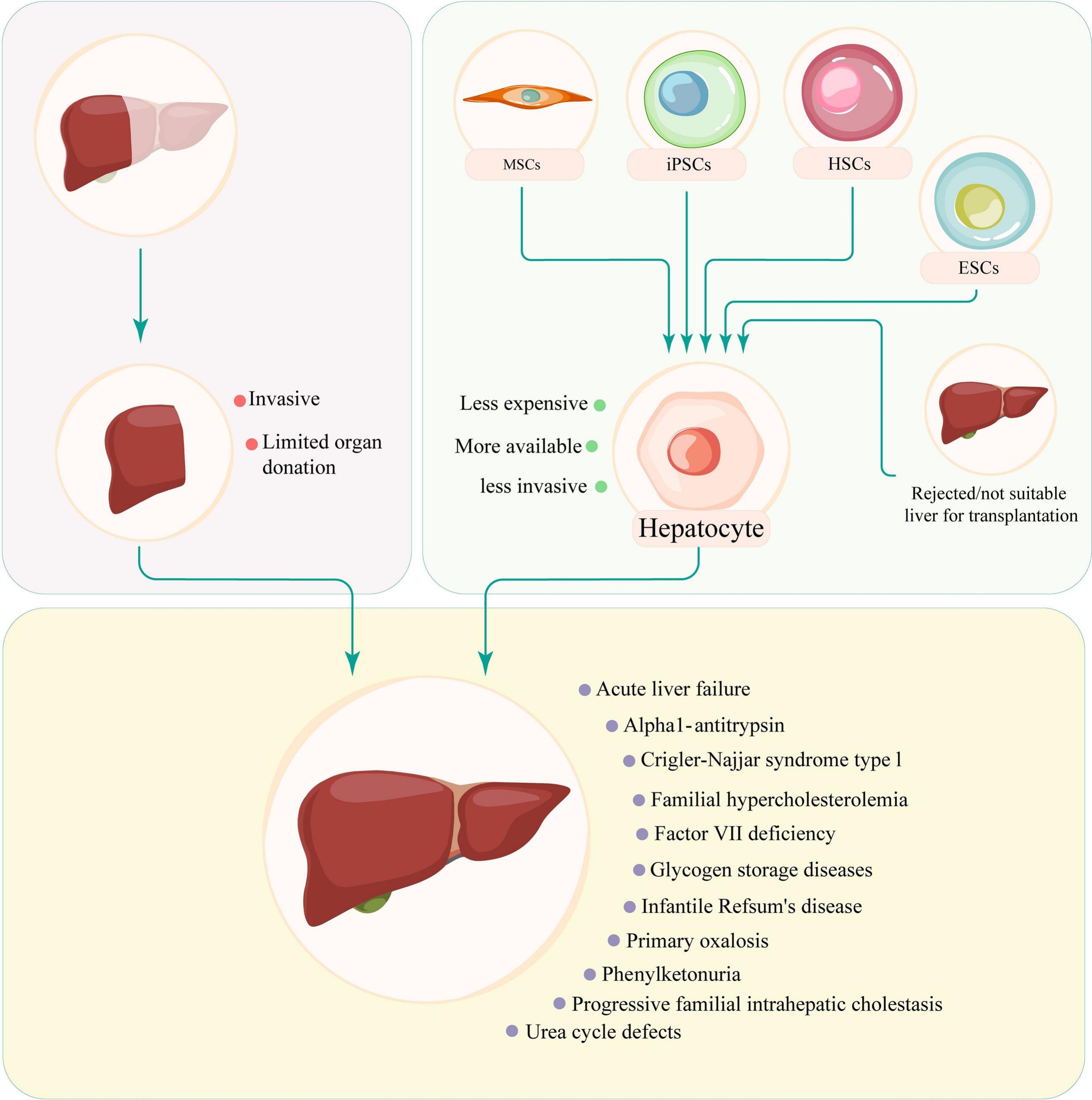
什么是肝细胞
肝细胞是肝脏的主要实质细胞,约占肝脏质量的70-80%,执行所有重要的肝脏特异性活动,如代谢、解毒、蛋白质合成和先天免疫激活。尽管肝脏可以自我再生,但肝病是全世界死亡的主要原因,导致器官功能障碍和生理变化,通常需要临床干预。虽然终末期肝病的唯一治疗方法是肝移植,但该过程是侵入性的,并且涉及有限的器官捐赠。肝细胞移植是肝移植的潜在替代方案,可以直接从供体肝脏(排斥或不适合肝移植)或分化的干细胞(ESC、iPSC、HSC和MSC)获得。
与肝移植相比,肝细胞移植具有创伤小、成本低、可及性高等优点。肝细胞在治疗急性肝衰竭、α1-抗胰蛋白酶、L型克里格勒-纳贾尔综合征、家族性高胆固醇血症、因子VII缺乏症、糖原贮积病、婴儿雷夫苏姆氏病、原发性草酸中毒、苯丙酮尿症、进行性家族性肝内胆汁淤积症等疾病方面显示出良好的治疗潜力。尿素循环缺陷(图5)。
什么是软骨细胞
软骨细胞是关节软骨中存在的唯一细胞类型,完全参与细胞外基质 (ECM) 的形成和周转。基于软骨细胞的治疗是治疗软骨缺陷的一种有前途的治疗方法。各种来源的软骨细胞已被提议用于细胞治疗,包括自体细胞、同种异体细胞和干细胞(ESC、iPSC、MSC)。同种异体肝细胞可以从尸体关节软骨和幼年多指供体中获得。具有高度软骨分化潜力的MSC和iPSC是有前途的干细胞,可以创造理论上无限的肝细胞来源。自体软骨细胞植入(ACI)是最早的基于细胞的修复软骨缺损的疗法之一,成功率很高。 ACI随着时间的推移不断发展,并使用机械、生物和化学支架来改善移植物中的细胞输送和保留。
这四个PC家族可以根据不同的生物学特征和机制应用于不同的临床应用。 PC能够同时输送多种生物活性物质,包括转化生长因子β-1(TGF-β1)、血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)和胰岛素样生长因子 (IGF)。人们提出了许多基于PC的再生应用,以促进牙科领域(牙髓、牙周、软骨、骨的再生)、骨科和运动医学(再生)领域中许多损伤的组织重塑和再生。
肌肉、肌腱和韧带损伤、半月板撕裂、足底筋膜炎、上髁炎、软骨缺损和膝关节 OA)、皮肤科(痤疮、脱发、皮肤溃疡、黄褐斑、色素沉着和烧伤的治疗)、整形外科(皮肤再生、毛发再生、软组织增强和乳房重建)、眼科(干眼症、干燥综合征、角膜激光屈光手术、难治性角膜溃疡的治疗) 、角膜上皮缺损、角膜病变、青光眼、色素性视网膜炎)、免疫学(感染性、炎症性和自身免疫性疾病的治疗)以及妇科(难治性子宫内膜、阿舍曼综合征、卵巢反应不良、硬化性苔藓、女性性行为、膀胱阴道瘘、压力性尿失禁和膀胱疼痛综合征)。
什么是内皮细胞
内皮细胞(EC)位于动脉、静脉和淋巴管的管腔中,控制和调节止血、通透性、炎症、凝血和血管生成。 EC可以通过直接分离自体EC和具有不同潜能的各种干细胞获得,例如多能(ESC、iPSC)、多能(HSC、MSC、NSC)、寡能(EPC)和单能(卫星干细胞、表皮干细胞)。
越来越多的证据表明,替换受损的内皮细胞可能是心血管疾病、动脉粥样硬化和腹主动脉瘤等血管疾病的一种有价值的治疗选择。组织工程结构的预血管化代表了再生医学植入之前的一种有前途的策略。
在眼器官中,需要角膜内皮细胞(CEnC)来控制和维持角膜脱水,其功能障碍或损伤可导致角膜水肿和视力障碍。成功生成专门的角膜内皮细胞有可能克服供体细胞短缺的问题,用于治疗人类角膜内皮功能障碍。
血液和免疫细胞
什么是红细胞
红细胞 (RBC) 或红细胞是最大的血细胞群体,缺乏细胞核、核糖体和线粒体等大多数细胞器。红细胞含有携氧蛋白血红蛋白,为全身细胞和组织提供氧气,充当中枢代谢调节剂。红细胞的特殊特性使其成为同种异体细胞疗法的有吸引力的候选者,
(1) O 阴性血液固有的生物相容性,
(2) 生物降解性(网状内皮系统自然去除),
(3) 表达治疗药物的高潜力通过基因改造生成工程化红细胞来产生蛋白质,减少药物副作用(通过多种免疫特权机制防止抑制性或不良宿主反应),
(4) 比循环治疗性蛋白质更低的靶向毒性由于红细胞仅限于实质器官和脾脉管系统(图6)。

由于独特的生物物理特性,红细胞已被引入作为一种有吸引力的载体,可以逐渐释放药物并充当生物传感器、生物反应器(酶载体)或靶向药物递送系统。红细胞可用于逐渐释放药理物质,这是长时间维持恒定的足够血浆药物水平所必需的。许多研究报告了红细胞装载不同类型药剂的潜力,例如细胞毒性药物(化疗药物)、激素(糖皮质激素、胰岛素)、凝血因子(因子IX和X)、镇痛剂(吗啡)和抗逆转录病毒药物。红细胞装载还用于免疫、癌症免疫治疗、酶治疗、免疫耐受诱导和诊断建议。
红细胞作为治疗酶载体的应用至少分为四个领域,包括化学解毒(酒精氧化酶、硫氰酸酶和磷酸三酯酶分别拮抗甲醇、氰化物和对氧磷)、溶栓治疗(尿激酶、链激酶和重组组织)纤溶酶原激活剂),代谢性疾病的治疗(葡萄糖脑苷酶,L-谷氨酸脱氢酶,谷氨酰胺合成酶,丙氨酸转氨酶,精氨酸酶,己糖激酶,葡萄糖氧化酶,乳酸2-单加氧酶和L-乳酸氧化酶,葡萄糖-6-磷酸脱氢酶,腺苷脱氨酶,胸苷磷酸化酶、尿酸酶、苯丙氨酸羟化酶和苯丙氨酸解氨酶)和抗肿瘤治疗(L-天冬酰胺酶、蛋氨酸-γ-裂解酶和精氨酸脱亚胺酶)。
什么是血小板
血小板,也称为血小板,是源自巨核细胞的最小无核血细胞,与凝血相关。此外,血小板在生理(止血、伤口愈合、炎症和免疫反应)和病理(冠状动脉综合征、中枢神经系统疾病、自身免疫性疾病、癌症和类风湿性关节炎)过程中发挥着重要作用(图6)。血小板至少含有三种分泌颗粒类型,包括致密颗粒(或δ颗粒)、α颗粒和溶酶体,它们携带不同的货物并在激活后释放,负责大多数血小板功能。如今,浓缩血小板已被开发并用于不同的病症和疾病(图6)。
血小板浓缩物根据其纤维蛋白结构和细胞组成分为富血小板血浆(P-PRP)、富白细胞和富血小板血浆(LPRP)、纯富血小板纤维蛋白(P-PRF)以及白细胞和血小板富含纤维蛋白(L-PRF)。
什么是巨噬细胞
巨噬细胞是普遍存在的免疫效应细胞,分布在所有组织和身体区室中,对于维持成人组织的稳态至关重要。血液单核细胞可以作为循环白细胞的子集进入组织,在那里它们进一步分化为巨噬细胞或树突状细胞。组织特异性巨噬细胞是辅助组织细胞,可以引起吞噬作用(死亡细胞和感染细胞),有助于维持组织更新、T 细胞耐受性以及细菌感染时启动免疫反应。提供先天免疫、有效死亡细胞清除和局部组织微环境调节的潜在能力使巨噬细胞成为各种疾病的细胞疗法的有吸引力的候选者。
巨噬细胞的三个主要来源用于其治疗方法,包括组织、iPSC和HSC。特定组织驻留的巨噬细胞可分为库普弗细胞(肝脏)、小胶质细胞(大脑)、破骨细胞和骨髓巨噬细胞(骨骼)、肺泡巨噬细胞(肺)、系膜细胞(肾脏)、囊下窦巨噬细胞(淋巴) 、肠固有层巨噬细胞(胃肠道)、朗格汉斯细胞(皮肤)以及胸膜和大腹膜巨噬细胞(浆膜组织)。
根据其表型和功能,巨噬细胞通常分为促炎性M1(经典激活的巨噬细胞)和抗炎性M2(选择性激活的巨噬细胞)。 M2巨噬细胞在肿瘤微环境中最为丰富,M2向M1的转化和免疫抑制状态的逆转可能是癌症治疗中令人鼓舞的治疗选择。有人声称,原发性肿瘤微环境巨噬细胞并非源自常驻巨噬细胞,而是从外周血单核细胞中招募而来。巨噬细胞应用的目标可以是:
- (1) 实现组织巨噬细胞的重新增殖,
- (2) 作为载体递送治疗剂(小分子、质粒DNA),以及
- (3) 通过基因工程巨噬细胞增强现有的巨噬细胞行为(CAR巨噬细胞)。
研究表明,基于巨噬细胞的疗法可以增强免疫力,并显示出治疗各种炎症性疾病的巨大潜力,其中包括癌症(乳腺癌、卵巢癌、结肠癌、慢性粒细胞白血病、胰腺癌、胶质母细胞瘤)、退行性和遗传性(阿尔茨海默氏病、帕金森病、戈谢病、丹吉尔病、慢性肉芽肿病、雷特综合征、慢性婴儿神经性皮肤和关节综合征、神经元蜡质脂褐质沉着症、家族性地中海热)感染性(金黄色葡萄球菌感染)、自身免疫性和炎症性(MS、炎症性肠病(IBD) )、RA)疾病(图6)。
什么是树突状细胞
树突状细胞 (DC) 是抗原呈递细胞 (APC) 的一个亚群,在介导先天性和适应性免疫反应中发挥着关键作用。 DC 促进针对抗原的免疫反应,并可以刺激细胞毒性和辅助性T淋巴细胞来对抗感染和癌症。 DC的另一个重要的免疫功能是诱导和维持免疫耐受,以维持稳态免疫稳态,从而导致对自身抗原的耐受。一般来说,DC 分为经典型(淋巴样和迁移性DC)和非经典型(浆细胞样和单核细胞来源的 DC)。
已经进行了多项临床和动物研究来评估DCs对各种病症和疾病的治疗作用,例如恶性肿瘤(黑色素瘤、前列腺癌、子宫内膜癌、非小细胞肺癌、肝细胞癌、结直肠癌和间皮瘤)、自身免疫性疾病(MS) 、类风湿性关节炎 (RA)、1型糖尿病和克罗恩病)、移植(肾脏和肝脏移植)、感染(HIV、乙型肝炎病毒感染、COVID-19 和利什曼病)(图6)。
什么是自然杀伤细胞
自然杀伤 (NK) 细胞是先天免疫系统的特殊效应淋巴细胞,对病毒感染的细胞和肿瘤细胞具有坚实的细胞毒性。为了获得NK细胞,人们引入了多种来源,包括外周血单核细胞、脐带血、永生化细胞系、HSC和iPSC。 NK 细胞具有多种特性,使其成为基于细胞的免疫疗法的独特特性,例如以不依赖于主要组织相容性复合体 (MHC) 的方式进行抗原识别、安全性以及现成生成的高潜力。
近年来,随着细胞技术的进步,已经开发出了表达合成嵌合抗原受体(CAR)的转基因细胞,这些细胞可以识别靶细胞上独特表达的特定抗原,目的是将细胞变成强大的抗肿瘤武器(Laskowski )。在临床上,CAR工程化的NK细胞增强了基于NK细胞的疗法的效力,并取得了有希望的结果,这代表了对持续创新的巨大热情。许多已完成和正在进行的临床研究一直在探索基于NK细胞的疗法的有效性,作为治疗感染(SARS-CoV-2、HIV、CMV、EBV、HBV)和血液学(淋巴瘤、骨髓瘤、白血病)和实体瘤(胃癌、胰腺癌、舌癌、食道癌、喉癌、咽癌、小细胞肺癌、非小细胞肺癌、肾癌、乳腺癌、卵巢癌、宫颈癌、神经母细胞瘤、肝癌)癌症、表达 HER2 的转移性实体瘤、表达ROBO1的实体瘤、MUC1阳性实体瘤、晚期恶性肿瘤、复发性恶性实体瘤、儿科实体瘤)恶性肿瘤(图6)。
什么是γδT细胞
γδ (γδ) T细胞是成人外周血和粘膜组织中具有适应性和先天免疫特性的独特T淋巴细胞亚群。与识别MHC分子上呈现的靶抗原的αβT细胞相反,γδT细胞与NK细胞类似,以不受MHC限制的方式识别其配体。激活的 γδT细胞显示出独特的功能,并在针对感染和肿瘤发生的免疫和免疫监视中发挥关键作用。除了TCR(T细胞受体)之外,NK受体(例如 NKG2D、DNAM-1、NKp30、NKp44 和 NKp46)也在δT细胞上表达,这些细胞识别肿瘤细胞上常见的应激诱导表面分子。
γδT细胞因其快速激活、直接细胞毒性、强大的细胞因子产生和间接抗肿瘤免疫反应而被提议作为过继性癌症免疫疗法的新型治疗候选者。根据γδ-T细胞的来源和扩增类型,基于γδ-T细胞的癌症免疫治疗有四种策略,包括体内扩增自体γδT细胞临床试验、离体扩增自体γδT细胞临床试验、体内扩增同种异体γδT细胞。细胞临床试验,以及离体扩大同种异体γδT细胞临床试验。
近年来,基于 γδ-T 细胞的癌症免疫疗法的效力和功效已在实体(胆管癌、胰腺癌、胃癌、非小细胞肺癌、肾细胞癌、结直肠癌)和血液学(包括混合癌)中得到评估。表型急性白血病(MPAL)、多发性骨髓瘤(MM)、浆细胞白血病(PCL)、NHL、CLL、CML和AML恶性肿瘤(图6)。有趣的是,γδ T 细胞疗法在治疗感染(真菌、细菌和病毒)方面具有广阔的治疗潜力,因为在HSCT后以及γδT细胞百分比高的个体中观察到感染发生率较低(图6)。
什么是CAR-T细胞
表达CAR-T细胞疗法已成为癌症治疗的革命性新支柱。CAR-T细胞经过工程改造,能够以不依赖 MHC 的方式识别和消除表达特定靶表面抗原的细胞。
多种CAR-T产品已获得美国食品和药物管理局 (FDA) 批准用于治疗侵袭性血液恶性肿瘤,包括非霍奇金淋巴瘤 (NHL)(lisocabtagene ciloleucel (liso-cel)、axicabtagene ciloleucel (axi-cel)) 、B细胞急性淋巴细胞白血病 (B-ALL)(tisagenlecleucel (tisa-cel)、brexucabtagene autoleucel (brexu-cel))、套细胞淋巴瘤 (brexu-cel)、滤泡性淋巴瘤 (axi-cel) 和 MM (idecabtagene) vicleucel (ide-cel)、ciltacabtagene autoleucel (cilta-cel)。世界各地已针对肝母细胞瘤、神经母细胞瘤、中枢神经系统肿瘤、肝细胞癌、晚期食管癌、非小细胞肺癌、淋巴瘤、骨髓瘤和白血病等不同癌症进行了CAR-T细胞疗法的临床试验(图6)。
此外,针对CAR-T细胞对各种实体瘤的有效性进行了大量研究,如脑癌、结直肠癌、胰腺癌、肾癌和肝癌、前列腺癌、卵巢癌、乳腺癌、胃癌和肺癌(Marofi)。然而,实体瘤中的CAR-T细胞疗法是一种相对较新的治疗干预措施,需要进行广泛的研究来评估其治疗实体瘤的安全性和可行性。
什么是肿瘤浸润淋巴细胞
肿瘤浸润淋巴细胞 (TIL)(T 细胞、B细胞和NK细胞)是适应性免疫系统的组成部分,能够检测肿瘤抗原并离开血流进入肿瘤,在介导癌症反应中发挥关键作用治疗方法。 TIL免疫疗法是一种对抗肿瘤的新治疗策略,具有良好的疗效和安全性。基于TIL的治疗过程首先是分离肿瘤组织的天然浸润淋巴细胞,进行体外扩增,然后对扩增的细胞施用一定剂量的IL-2,以改善和增强免疫治疗。 TIL在癌症治疗中的成功临床应用已被证明对宫颈癌、结直肠癌、胆管癌、非小细胞肺癌和乳腺癌患者具有令人印象深刻的临床益处(图6)。
什么是调节性T细胞
调节性T细胞 (Treg) 是一种CD4+T淋巴细胞,通过调节免疫反应来维持体内平衡和自我耐受。已经证明,Tregs通过抑制免疫系统来促进癌症免疫、抗生素耐药性、过敏和移植。临床和动物研究评估了Treg给药对许多病症和疾病的安全性和有效性,表明基于Tregs的免疫疗法是癌症、器官移植(皮肤、心脏、肾脏、肝脏)、自身免疫和炎症性疾病(GvHD、寻常型天疱疮、SLE、IBD、自身免疫性肝炎、MS、T1D、过敏、哮喘、COVID-19)(图6)。
为了提高Treg的特异性、稳定性、功能活性和细胞治疗的递送,需要考虑许多努力,例如产生工程化T细胞受体(TCR)和嵌合抗原受体(CAR)来工程化抗原特异性、基因组编辑和生成更有效、更稳定的Tregs群体、从干细胞(iPSC和ESC)从头生产Tregs,以及获得用于更广泛应用的同种异体Tregs产品(表2)。
结论
如今,细胞疗法已成为一种有前途的再生医学方法,可以征服疾病,并比标准疗法取得更好的治疗效果。根据疾病/病症的类型和状态,可以应用基于干细胞或完全分化细胞的最佳和最合适的治疗策略。一般来说,细胞治疗后获得有效结果的关键因素可以针对正确的患者年龄以及正确的细胞施用类型、剂量和时间。
参考资料:https://doi.org/10.1016/j.cdev.2024.203904
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请及时跟本公众号联系,我们将在第一时间处理。



 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号