中风是全球第二大死因(约550万),也是全球伤残调整生命年(约1.164亿)的第二大常见死因。在美国,成人中风的患病率为2.9%,每年约有795,000人新发或复发中风。尽管目前推荐的药物溶栓、血管内介入和康复策略等疗法已被证明是有益的,但许多中风患者尽管接受了治疗,但仍存在残余缺陷。
干细胞(神经干细胞、造血干细胞和间充质干细胞)形式的再生疗法正在成为一种很有前途的治疗策略,可预防中风相关组织损伤、促进受损组织修复和增强功能恢复。
干细胞 (SC) 通过以下机制发挥作用,这些机制涉及整合到宿主大脑中以替换受损的宿主组织,神经保护涉及炎症和免疫反应的下调,抑制移植宿主的细胞凋亡以及通过血管再生增加内源性修复过程,宿主脑可塑性的诱导和内源性祖细胞的募集。由于中风涉及多种细胞类型的损失,包括血管、星形胶质细胞、神经元和少突胶质细胞,干细胞疗法的神经保护和恢复特性预示着中风治疗的前景广阔。由于相似的病理生理学和治疗策略,包括心肌梗死 (MI) 和卒中的溶栓治疗,我们也可以将MI中基于细胞的治疗经验作为卒中管理的指南。
干细胞治疗缺血性中风患者的安全性和有效性
已经有多项临床前和临床研究来确定在中风患者中使用干细胞的安全性和有效性。然而,有多种因素可能与干细胞的安全性和有效性相关,包括宿主因素、干细胞的类型和来源、剂量和递送途径、距离中风的时间以及安全性和结果的测量。
本研究的目的是强调过去六年发表的近期临床试验的结果,以进一步确定干细胞疗法在缺血性中风患者中的安全性和有效性,并为未来的研究提供信息。
方法
我们使用PubMed数据库手动搜索了2014年至2020年间发表的临床试验,搜索策略为:“干细胞或干细胞疗法”和“中风或大脑中动脉或MCA或大脑前动脉或ACA或缺血性中风”以及“人类”和“临床试验”。我们还搜索了 http://clinicaltrials.gov以获取有关这些研究的一些额外信息。
结果
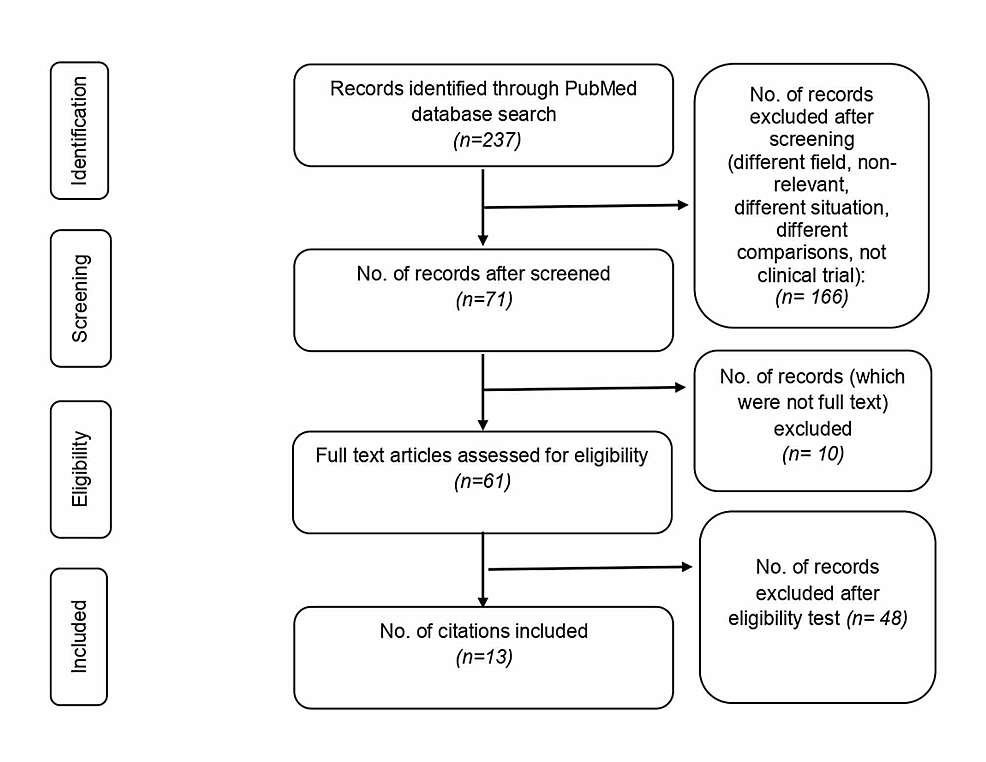
我们从数据库搜索中确定了237篇文章。通过阅读摘要进行筛选,最终纳入了71项研究。排除是因为不同的研究领域、不同的情况、不相关和不同的研究设计。我们仅找到61篇文章的全文。最终选择符合纳入标准的13篇文章进行综述。选择过程详见图1。13项研究中有7项有对照组,其中一项是历史对照。
干细胞治疗缺血性脑卒中的临床试验详细数据
研究成果
| 第一作者年份 | 国家及地区 | 临床试验 | 基线神经状态 | 参加人数(对照) | 年龄 | 性别(男/女) |
| 征收2019[1] | 美国 | I/II期多中心、开放标签 | 平均 NIHSS(范围):8[6.5至10]平均BI±SD:65±29平均老年抑郁量表评分±SD:5.1±3.5 | 36 | 平均值(范围)61.1 [39–84] | 27/9 |
| 萨维茨 2019[2] | 美国 | II期随机、假对照、平行组、多中心盲法评估,ITT | 平均 NIHSS:11mRS ≥3。 | 29(19) | 平均值 (SD):59.3 (10.03) | 20/9 |
| 拉斯科维茨 2018[3] | 美国 | I期、多站点、开放标签、前瞻性 | NIHSS中位数:11mRS中位数:4 BI中位数:17.4 | 10 | 中位数(范围):65.5 (45–79) | 10M |
| 巴蒂亚 2018[4] | 印度 | II期前瞻性、随机、对照、开放标签、盲终点 | NIHSS:>7,平均值:10.6 | 10(10) | 平均值±SD:57±12.2 | 8/2 |
| 赫斯2017[5] | 美国/英国 | II期、随机、双盲、安慰剂对照、剂量递增试验 | NIHSS:8至20,平均值 (SD):13·4 (3·6) | 65(61) | 平均值 (SD):61·8 (11·4) | 35/30 |
| 卡拉德卡 2016[6] | 英国 | I期开放标签、单中心、剂量递增研究 | 中位数 (IQR):NIHSS:7(6–8) mRS:3(3–4) BI:12(11–14) | 11 | 中位数 (IQR):68 (61–75) | 不可用 |
| 小枝2016[7] | 英国 | 单中心、试点2×2因子随机化 (1:1) 安慰剂对照试验、前瞻性、盲法结果 | NIHSS(平均值 (SD)):6.7(4.7) mRS:>1 | 30(30) | 平均值 (SD):66.8 (8.4) | 17/13 |
| 斯坦伯格 2016[8] | 美国 | I/IIa期2年,开放标签,单臂 | 平均值 (SD):NIHSS 9.44 (1.89) mRS:3.22 (0.43) ESS 58.44 (6.27) 平均每搏输出量:42cm3。 | 18 | 平均值 (SD) 61.3 (10.29) | 7/11 |
| 田口2015[9] | 日本 | 具有历史对照的I/IIa 期非随机开放标签研究设计 | 平均值±标准差:NIHSS:16.6±4.7 | 12(59) | 平均值±标准差:67.4±5.4 | 11/1 |
| 普拉萨德 2014[10] | 印度 | II期、多中心、平行组、随机试验和盲法结果评估 | 中位数 (IQR):NIHSS 11 (6) BI:25 (28.7) | 60(60) | 平均值±SD:50.7±11.6 | 41/19 |
| 巧2014[11] | 中国 | 非随机、开放标签单中心单臂临床试验 | 平均值:NIHSS:15.5 mRS:5 BI:5 | 2个 | 平均值:83 | 2F |
| 巧2014[12] | 中国 | 非随机、开放标签单中心单臂 | 平均值:NIHSS:4.5 mRS:4.25 BI:58.75 | 4个 | 平均值:42.75 | 3/1 |
| 班纳吉 2014[13] | 英国 | I期前瞻性、非随机、开放标签 | NIHSS:≥8 | 5个 | 平均值:58.2 | 3/2 |
| 陈2014[14] | 中国台湾 | II期随机、单盲对照 | 美国国立卫生研究院:9至20 | 15(15) | 平均值(范围):50.1 (42-66) | 12/3 |
M:男性,F:女性,ITT:意向性治疗,SD:标准差,IQR:四分位数间距,NIHSS:美国国立卫生研究院卒中量表,mRS:改良 Rankin 评分,BI:Barthel 指数,ESS:欧洲中风量表,NA:不可用
中风的性质与干细胞移植的方式
| 第一作者年份 | 卒中类型和干预时间 | 干细胞类型 | 路线和剂量(米=百万) |
| 征收2019 | >6个月的缺血性中风 | 同种异体间充质干细胞 | IV/0.5-1.5m个细胞/kg |
| 萨维茨2019 | MCA皮质和非皮质缺血性卒中后11-17天 | 自体BM衍生的ALD-401 | IA(ICA)/ 平均3.08m个细胞 |
| 拉斯科维茨2018 | MCA皮质缺血性卒中后3-9天 | 非 HLA 匹配、ABO 匹配、不相关的同种异体 UCB | IV/单剂量 8.3 至 33.4 m TNCC/kg UCB |
| 巴蒂亚2018 | MCA缺血性中风后8-15天 | 骨髓来源的单核细胞 | IA/ 最大 500 m 单元格 |
| 赫斯2017 | 半球皮质ACA梗死后24-48小时 | 多能成体祖细胞 | IV/(400 或 1200 m 细胞细胞) |
| 卡拉德卡 2016 | MCA、ACA或PCA皮质和皮质下缺血性卒中后 32 (14–44) 个月的中位 (IQR) | 同种异体永生化人神经干细胞 | 脑内植入/单剂量 2、5、10 或 20 m hNSCs |
| 小枝2016 | TACS、PACS、LACS、TIA后平均(范围)为22.0 (7–36) 个月 | 脑脊液 | SC/非格司亭,1 m iu/kg |
| 斯坦伯格 2016 | MCA或LSA皮质或皮质下缺血性卒中后平均(范围)为22.0 (7–36) 个月 | 改良的骨髓间充质干细胞 | 外科移植/2.5、5.0 或 10 m SB623 细胞。 |
| 田口2015 | MCA、ICA、PCA、ACA中风后7-10天 | 自体骨髓单个核细胞 | IV/ 25000 和 34000 m 细胞 |
| 普拉萨德 2014 | 缺血性中风后18.5(9.2) 天的中位数 (IQR) | 自体骨髓干细胞 | IV/ 280.75 m 单核细胞,含 2.9 m CD34+ 细胞 |
| 巧2014 | ACA、MCA缺血性卒中后平均2.5个月 | 源自 UC 的 MSC | IV/MSCs(0.5 m/kg 体重)4 剂 |
| 巧2014 | ACA、MCA缺血性卒中后平均9.25个月 | MSCs+ NSPCs | IV MSCs(0.5 m/kg,随后植入小脑延髓池:MSCs(5 m/患者)和 NSPCs(6 m/患者) |
| 班纳吉2014 | <7天的严重ACA缺血性卒中 | 自体、免疫选择的 CD34+ 干/祖细胞 | IA/ 1.2-2.79米细胞 |
| 陈2014 | MCA缺血性卒中后平均 ±SD(范围)为2.7±1.4(0.6-5) 年 | G-CSF 和 CD34(+) 免疫分选的 PBSC | SC G-CSF 注射(15 µg/kg/天)和植入 3-8 m CD34(+) 免疫分选的 PBSC |
表4总结了纳入研究中报告的治疗结果(不良事件和疗效)。对于对照研究,治疗组的结果指标与对照组的结果指标进行了比较。
| 第一作者年份 | 不良事件(AE) | 功效 |
| 征收2019 | 2例死亡 (CAD) 和 15 例严重 AE(均与治疗无关):感染、血管疾病和疼痛综合征。 | 12 个月时:所有行为终点均显着增加:BI 增加 10.8±15.5 点(P<0.001);实现良好功能结果 (BI ≥ 95) 的患者比例从基线时的 11.4% 增加到 35.5%。NIHSS 下降了 −2 [−3.5 至 −0.5]。老年抑郁量表评分变化了 -1.4±3.8。 |
| 萨维茨 2019 | 没有严重的治疗相关 AE,除了癫痫发作(治疗组的频率是治疗组的 4 倍,所以可能与治疗相关) | 1 年时:平均 mRS、BI、NIHSS 无统计学显着差异。给药剂量与 mRS 结果之间无相关性 |
| 拉斯科维茨2018 | 只有一种 AE(中度严重性瘙痒症)可能与研究性治疗相关。 | 3 个月时:相对于基线,所有参与者的 mRS(平均 ±SD 2.8 ± 0.9)和 NIHSS(平均 5.9 ± 1.4)至少提高了 1 级。BI 增加平均值±标准差 52.0 ± 24.7;范围 10–80 |
| 巴蒂亚 2018 | 所有患者均未见手术相关并发症。死亡率:2(对照)/1(处理)(0.53);1(治疗)中的新梗死(0.305);都微不足道 | 6 个月时:治疗组 80% 的患者与对照组的 40% 患者有良好的临床结果(mRS 评分 < 2)(p=0.068)。两组的 mRS 均有改善,但仅在治疗组具有统计学意义 (P = .009)。仅干预组的 BI 显着改善 (P =. 004) |
| 赫斯2017 | 危及生命的不良事件或死亡:8 例 (12%) 治疗组与 15 例 (25%) 对照组。继发感染:治疗组 25 例 (39%) vs 对照组 29 例 (48%) | 1 年时:51% 的治疗组和 44% 的对照组达到 mRS ≤2;49% 的治疗组和 46% 的对照组的 NIHSS 改善≥75%;23% 的治疗组与 8% 的对照组取得了优异的结果 (p= 0·0206) [优异的结果:mRS ≤1、NIHSS ≤1 和 BI ≥95 的综合结果] |
| 卡拉德卡 2016 | 1例新发缺血性中风(非治疗相关浅表恶性黑色素瘤,1例有慢性日晒史。 | 2 年时:NIHSS 评分中位数提高 2 分(范围:0-5)。12 个月时:患者报告的整体健康状况中位数改善了 18 分(IQR –5 至 30) |
| 小枝2016 | 治疗组 (9) 报告严重不良事件的患者多于对照组 (3),尽管无统计学意义 (p = 0.10) | 1 年时:治疗组和对照组之间的依赖或残疾结果没有显着差异。3 个月时:治疗组 (+0.15) 与对照组 (-0.02) 相比,EQ-5D QoL 显着改善 |
| 斯坦伯格 2016 | 至少1次治疗中出现的不良事件。6名患者经历了6起严重不良事件(2起可能或肯定与外科手术相关;无一起与细胞治疗相关)。无剂量限制性毒性或死亡 | 12 个月时:显着改善:(1) ESS:平均增加 6.88(95% CI,3.5-10.3;P<0.001),(2) NIHSS:平均减少 2.00(95% CI,-2.7 至 -1.3;P <0.001),(3) Fugl-Meyer 总分:平均增加 19.20(95% CI,11.4-27.0;P<0.001),以及(4)Fugl-Meyer 运动功能总分:平均增加 11.40(95% CI,11.4-27.0;P<0.001) 4.6-18.2;P<0.001)。mRS 无变化 |
| 田口2015 | 1人:复发性中风。否则,没有观察到施用骨髓细胞的明显副作用。 | 1 个月时:NIHSS 评分的平均改善为 4.8 ± 4.6 (P |
| 普拉萨德 2014 | 没有严重的不良事件:2个臂中的其他事件相似。 | 6 个月时:BMSCs 组和对照组在 BI(63.1 对 63.6;P=0.92)、mRS 偏移分析(P=0.53)或评分 >3(47.5% 对 49.2%;P=0.85)方面无显着差异, NIHSS 评分(6.3 对 7.0;P=0.53),梗塞体积变化(-11.1 对 -7.36;P=0.63)。 |
| 巧2014 | 6例低热,每次治疗后一般持续2-4天。没有神经功能恶化或神经系统感染的证据。在 2 年的随访中未发现肿瘤发生。 | 2 年时:改善神经功能 (NIHSS)、残疾水平 (mRS) 和日常生活能力 (BI)。 |
| 班纳吉 2014 | 无明显的治疗相关不良反应。一名患者在输注后 2 周出现肾功能障碍,随后发生肺炎。 | 6 个月时:临床功能评分(mRS和NIHSS)的改善和病变体积的减少 |
| 陈2014 | PBSC 组或对照组在 G-CSF 治疗后的随访期内无死亡、严重 AE 或其他不良症状。 | 12 个月时:NIIHS等级9.3±0.5至5.5±1.8级,ESS等级69.3±7.8至76.1±8.1级,EMS等级23.9±8.2至30.5±8.8级,mRS等级2.9±0.3至2.1±0.3级PBSC组(显着更高)与对照组相比。 |
CAD:冠状动脉疾病,GCSF:粒细胞集落刺激因子,PBSC:外周血干细胞,NIHSS:国立卫生研究院卒中量表,BI:Barthel指数,mRS:改良Rankin评分,SD:标准差,IQR:四分位数范围,EQ-5D QoL:欧洲生活质量5维问卷,ESS:欧洲中风量表,EMS:ESS运动分量表,BMSC:骨髓干细胞
讨论
在这项研究中,我们试图回顾过去六年在缺血性中风患者中进行的关于治疗安全性和有效性的干细胞治疗临床试验的结果。
在我们的审查中,我们纳入了2014年至2020年进行的13项临床试验,这些试验使用干细胞治疗缺血性中风患者。13项研究中有7项是随机对照试验 (RCT),6项是单臂研究。
在纳入的临床试验报告的不良事件中,只有轻微或不太严重的不良事件是由干细胞治疗本身引起的。
关于给药途径,尽管动脉内 (ia) 优于静脉内 (iv) 途径,因为在ia途径中没有首过代谢,但我们审查的七项研究中有六项使用iv途径与阳性结果相关,这些研究产生了与通过ia或脑内途径相比与iv途径相关的相似或更大的益处。
结论
我们发现了关于干细胞治疗缺血性中风疗效的混合结果。安全性评估显示出有希望的结果,因为与细胞疗法相关的副作用很小。尽管干细胞疗法似乎是未来治疗中风患者的一种有前途的策略,但我们得出结论,在我们将干细胞用于临床之前,该领域需要更多关于中风患者使用干细胞的安全性和有效性的证据。
主要参考资料:Gautam J, Alaref A, Hassan A, et al. (August 21, 2020) Safety and Efficacy of Stem Cell Therapy in Patients With Ischemic Stroke. Cureus 12(8): e9917. doi:10.7759/cureus.9917。
- Phase I/II study of safety and preliminary efficacy of intravenous allogeneic mesenchymal stem cells in chronic stroke. Stroke. 2019, 50:2835-2841. 10.1161/STROKEAHA.119.026318
- Savitz SI, Yavagal D, Rappard G, et al.: A phase 2 randomized, sham-controlled trial of internal carotid artery infusion of autologous bone marrow-derived ALD-401 Cells in patients with recent stable ischemic stroke (RECOVER-Stroke). Circulation. 2019, 8:192-205. 10.1161/CIRCULATIONAHA.117.030659
- Laskowitz DT, Bennett ER, Durham RJ, Volpi JJ, Wiese JR, Frankel M, Shpall E: Allogeneic umbilical cord blood infusion for adults with ischemic stroke: clinical outcomes from a phase I safety study. Stem Cells Transl Med. 2018, 7:521-529. 10.1002/sctm.18-0008
- Bhatia V, Gupta V, Khurana D, Sharma RR, Khandelwal N: Randomized assessment of the safety and efficacy of intra-arterial Infusion of autologous stem cells in subacute ischemic stroke. Am J Neuroradiol. 2018, 39:899-904. 10.3174/ajnr.A5586
- Hess DC, Wechsler LR, Clark WM, et al.: Safety and efficacy of multipotent adult progenitor cells in acute ischaemic stroke (MASTERS): a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Neurol. 2017, 16:360-368. 10.1016/S1474-4422(17)30046-7
- Kalladka D, Sinden J, Pollock K, et al.: Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 2016, 388:787-96. 10.1016/S0140-6736(16)30513-X
- Sprigg N, O’Connor R, Woodhouse L, et al.: Granulocyte colony stimulating factor and physiotherapy after stroke: results of a feasibility randomised controlled trial: stem cell trial of recovery enhancement after stroke-3 (STEMS-3 ISRCTN16714730). PLoS One. 2016, 9:0161359. 10.1371/journal.pone.0161359
- Steinberg GK, Kondziolka D, Wechsler LR, et al.: Clinical outcomes of transplanted modified bone marrow-derived mesenchymal stem cells in stroke: a phase 1/2a study. Stroke. 2016, 47:1817-24. 10.1161/STROKEAHA.116.012995
- Taguchi A, Sakai C, Soma T, et al.: Intravenous autologous bone marrow mononuclear cell transplantation for stroke: phase1/2a clinical trial in a homogeneous group of stroke patients. Stem Cells Dev. 2015, 1:2207-18. 10.1089/scd.2015.0160
- Prasad K, Sharma A, Garg A, et al.: Intravenous autologous bone marrow mononuclear stem cell therapy for ischemic stroke: a multicentric, randomized trial. Stroke. 2014, 45:3618-24. 10.1161/STROKEAHA.114.007028
- Qiao LY, Huang FJ, Zhao M, et al.: A two-year follow-up study of cotransplantation with neural stem/progenitor cells and mesenchymal stromal cells in ischemic stroke patients. Cell Transplant. 2014, 23:65-72. 10.3727/096368914X684961
- Banerjee S, Bentley P, Hamady M, et al.: Intra-arterial immunoselected CD34+ stem cells for acute ischemic stroke. Stem Cells Transl Med. 2014, 3:1322-30. 10.5966/sctm.2013-0178
- Chen DC, Lin SZ, Fan JR, et al.: Intracerebral implantation of autologous peripheral blood stem cells in stroke patients: a randomized phase II study. Cell Transplant. 2014, 23:1599-612. 10.3727/096368914X678562
版权声明:本网站所有注明“来源:杭吉干细胞科技”或“来源:杭吉干细胞科技”的文字、图片和音视频资料,版权均属于杭吉干细胞科技网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:杭吉干细胞科技”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信