国内干细胞产业在世界各国“你追我赶”的激烈竞争氛围中,已经从过去的跟跑、并跑,迅速进入领跑世界再生医学的国际第一方阵。据CDE官网显示,截至2023年8月,已有12款干细胞产品提交IND审批,与之相比的是2021~2022两年共审批了31项,总以见得干细胞产品的研发力度日益增强。以间充质干细胞产品为主,涉及的适应症主要包括肝脏疾病(如肝硬化和肝衰竭等)、退行性疾病(如膝骨关节炎等)以及自身免疫病(如狼疮肾炎)等领域。这也预示着随着干细胞新药研发进展与监管路径的逐渐明晰,干细胞临床转化已经迎来发展的“黄金期”。
以下整理了国内各企业进入临床的干细胞进展情况(排名不分先后,如有遗漏,欢迎补充),iPSC将另外整理敬请期待。
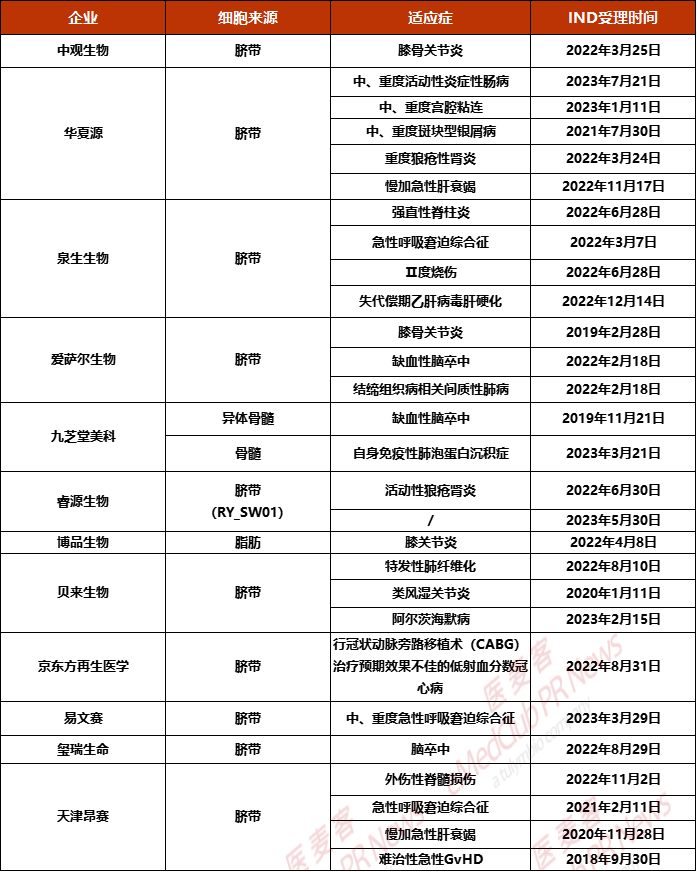
中观生物
2022年3月25日,中观生物研发的人脐带间充质干细胞注射液(ZGHUM- SC001)获IND受理,适应症为膝骨关节炎。作为一种来源于人脐带“WHARTON’S JELLY(华通氏胶)” 的间充质干细胞,具有一般MSCS特性,包括自我更新、多向分化、免疫调控、 造血支持、分泌多种细胞因子、抗菌作用、低免疫原性、损伤修复、未见成瘤性等。
华夏源
2023年7月21日,据CDE官网显示,华夏源原研干细胞产品“ELPIS人脐带间充质干细胞注射液”第五项适应症的临床试验申请(IND)获得受理。本次ELPIS产品是经CDE受理的华夏源第五个适应症为中、重度活动性炎症性肠病,属于自身免疫性疾病中较为常见的一类疾病。
此前,这款干细胞新药申报的四个适应症,中、重度慢性斑块型银屑病、重度狼疮性肾炎、慢加急性(亚急性)肝衰竭和中、重度宫腔粘连均已获得开展新药临床试验默示许可。
泉生生物
2022年12月14日,据CDE官网公示,泉生生物的“人脐带间充质干细胞注射液”获批临床,适应症为失代偿期乙肝病毒肝硬化。这是泉生生物继“轻至中度急性呼吸窘迫综合征(ARDS)、强直性脊柱炎、Ⅱ度烧伤”之后斩获的第四个适应症。
爱萨尔生物
2022年2月18日,爱萨尔生物“人脐带间充质干细胞注射液”的药物临床试验申请获受理,适应症为缺血性脑卒中、结缔组织病相关间质性肺病(CTD-IP),这是继膝骨关节炎后斩获的适应症。
九芝堂美科
2023年6月9日,九芝堂美科所提交的“人骨髓间充质干细胞注射液”新药临床试验申请(IND)获NMPA默示许可,适应症为自身免疫性肺泡蛋白沉积症(aPAP),是九芝堂美科自主研发的冷冻保存型干细胞制剂,源自健康年轻成人供者骨髓,全程在模拟人体真实生理环境——低氧条件下培养。这是国内首次使用干细胞治疗自身免疫性肺泡蛋白沉积症(aPAP)的临床试验申请。
除了该款产品获批临床外,九芝堂美科还迎来了一项重要进展。近期,九芝堂美科缺血耐受人同种异体骨髓间充质干细胞(it-hMSC)治疗缺血性脑卒中Ⅰ期临床试验已完成全部参与者入组,且表现出良好的安全性,经国家药品监督管理局药品审评中心评估,同意本项目进入Ⅱa期临床试验。这是中国首个使用进口干细胞治疗神经系统大适应症的临床试验。
睿源生物
2023年5月30日,据CDE官网公布,睿源生物申报的“RY_SW01细胞注射液”获IND受理,是一款人脐带间充质干细胞来源的干细胞疗法。此前,2022年RY_SW01获得临床默示许可,适应症为狼疮性肾炎(LN)。
博品生物
2022年6月30日,CDE官网显示,博品生物自主研发的Ⅰ类生物制品“人源脂肪间充质干细胞注射液”IND申请获批,适应症主要用于膝骨关节炎(KOA)的治疗。此次获批的基于人源脂肪间充质干细胞(ADMSC)的干细胞疗法,具有多向分化潜力,具有强大的增殖能力和多向分化潜能,在不同的诱导条件下可以分化成不同的组织,如骨组织、软骨组织、脂肪组织等。
贝来生物
2023年5月9日,北京贝来生物科技有限公司“人脐带间充质干细胞注射液”新药产品获国家药监局IND批准,适应症为阿尔茨海默病,通过其强大的抗炎、免疫调节、淀粉样斑块清除、增强神经发生等多种功能,有望成为治疗AD的新手段。这也是贝来生物继“特发性肺纤维化、类风湿关节炎”之后斩获的第三个适应症。
京东方再生医学
2022年11月22日,据CDE官网公示,京东方再生医学的“人脐带间充质干细胞膜片”获批临床,拟用于行冠状动脉旁路移植术(CABG)治疗预期效果不佳的低射血分数冠心病,这也是国内首款获批临床的干细胞膜片新药。
易文赛
2023年6月21日,易文赛的“人脐带间充质干细胞注射液”新药临床试验申请(IND)获NMPA默示许可,适应症为中、重度急性呼吸窘迫综合征(ARDS)。人脐带间充质干细胞注射液由易文赛自主研发,活性成分是从健康新生儿脐带组织经体外分离、筛选、扩增后的人脐带间充质干细胞。
玺瑞生命
2022年8月29日,据CDE公示,玺瑞生命引进的“Cytopeutics®脐带间充质干细胞(Neuroncell-EX)”临床试验的申请已受理,适应症为脑卒中。据悉,这是来自马来西亚世德生物公司的重点项目——间充质干细胞治疗脑中风,且拥有国际专利,患者在90 天黄金期内接受干细胞疗程,有90%机会恢复发病前90%状态。
天津昂赛
2023年1月17日,天津昂赛自主研发的”注射用间充质干细胞(脐带)”新适应症获批IND,用于治疗外伤性脊髓损伤。CDE显示,此前这款”注射用间充质干细胞(脐带)”已经获批了三项适应症。分别为:难治性急性移植物抗宿主病(GvHD)、慢加急性(亚急性)肝衰竭、急性呼吸窘迫综合征。
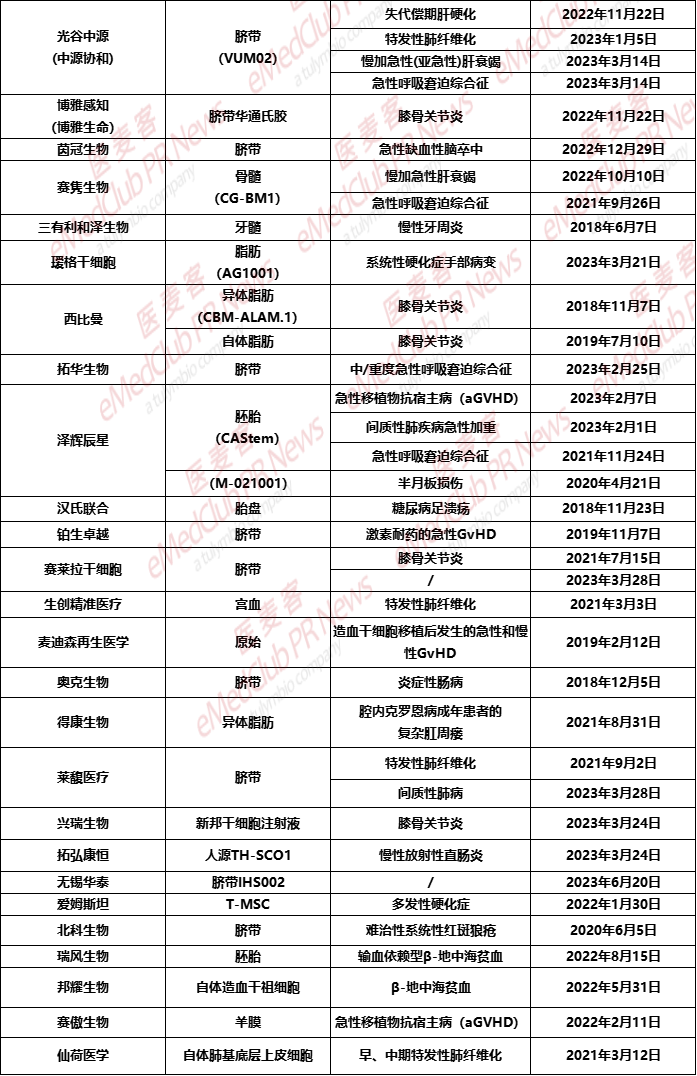
中源协和
2023年6月2日,据CDE官网公示,中源协和旗下全资子公司武汉光谷中源药业的VUM02注射液获得两项临床试验默示许可,适应症分别为慢加急性(亚急性)肝衰竭患者和急性呼吸窘迫综合征。而此前获批的适应症为特发性肺纤维化与失代偿肝硬化。VUM02注射液 (人脐带源间充质干细胞注射液)是中源协和自主研发的冷冻保存型干细胞制剂,是由健康新生儿脐带组织经体外分离、筛选、扩增后制备的人脐带源间充质干细胞(UC-MSC)悬液。
博雅感知
2023年2月23日,据CDE官网显示,博雅生命旗下子公司,博雅感知提交的”华通氏胶间充质干细胞注射液”临床试验申请获得临床默示许可。适应症为:膝骨关节炎。脐带间充质干细胞(hUC-MSCs)是存在于脐带华通氏胶(Wharton’s jelly)和血管周围组织中的一种间充质干细胞。
茵冠生物
2022年12月29日,据CDE官网公示,茵冠生物的人脐带间充质干细胞注射液IND申请获得受理。这是首个深圳本土干细胞药品临床试验批件,填补了深圳在干细胞治疗急性缺血性脑卒中领域的空白,将为深圳乃至全国干细胞药物的临床转化应用及产业化进程发挥积极的推动作用。
赛隽生物
2022年12月29日,据CDE官网公布,赛隽生物CG-BM1异体人骨髓间充质干细胞注射液新适应症:慢加急性肝衰竭(ACLF)IND申请获得临床默示许可。据悉,这是一款由赛隽生物自主研发的异体干细胞疗法,在2021年已有适应症获得临床默示许可,用于治疗感染引起的中重度成人急性呼吸窘迫综合征(ARDS)。
三有利和泽生物
2018年6月7日,据CDE官网显示,三有利和泽生物和首都医科大学联合申报的人牙髓间充质干细胞注射液的新药研究性(IND)申请获得受理。适应症为:慢性牙周炎,如慢性牙周炎所致的牙周组织缺损,有效成分是人牙髓间充质干细胞,取自健康志愿者拔除的智齿或正畸牙的牙髓腔,具有较强的组织再生和免疫调节等生物学及免疫学特性。
瑷格干细胞
2023年3月21日,据CDE官网显示,瑷格干细胞提交的“人脂肪间充质干细胞注射液”新药研究性(IND)申请获得受理,适应症为治疗系统性硬化症手部病变。
西比曼
2019年9月25日,CDE官网显示,西比曼公司获得第二项干细胞新药的临床默示许可——自体人源脂肪间充质祖细胞注射液(ReJoin®)用于治疗膝骨关节炎,由采集患者自身脂肪组织后,使用西比曼生物科技集团的“专用培养基”(无血清和无抗生素)和专有配方培养和制备而成的。
2023年4月3日,西比曼旗下异体人源脂肪间充质祖细胞注射液AlloJoin®的 III 期临床试验。AlloJoin®是中国第一个自主研发并经CDE默示许可直接进入II期临床的创新干细胞药品,同时也是中国第一个进入III期临床的针对膝骨关节炎的干细胞药物。此前,AlloJoin的IND申请于2018年11月7获得国家药监局受理。
拓华生物
2023年2月25日,拓华生物自主研发的I类创新药“人脐带间充质干细胞注射液”新药研究性(IND)申请获得受理,,适应症为治疗中/重度急性呼吸窘迫综合征。
泽辉生物
2023年4月18日,据CDE官网公示,泽辉生物的人胚干细胞产品“CAStem细胞注射液”两项新适应症获批临床,分别用于治疗急性移植物抗宿主病(aGVHD)和间质性肺疾病急性加重。此前,这款CAStem细胞注射液已获批开展多项临床,包括针对急性呼吸窘迫综合征、新冠肺炎相关肺纤维化、半月板损伤等。
汉氏联合
2018年11月23日,据CDE官网获悉,汉氏联合研发的人胎盘间充质干细胞凝胶获临床试验默示许可,用于治疗糖尿病足溃疡。这是国内第2项干细胞新药IND获得受理,也是获得受理的第一项“细胞凝胶剂”新药IND。
铂生卓越
2019年11月7日,从CDE官网获悉,铂生卓越干细胞新药人脐带间充质干细胞注射液临床试验申请,默许通过。适应症是:用于治疗激素耐药的急性移植物抗宿主病,给药方式属于静脉滴注。
赛莱拉干细胞
2021年9月26日,据CDE官网显示,赛莱拉干细胞研发的国家1类创新药——人脐带间充质干细胞炎新药获得CDE临床试验默示许可,用于治疗膝骨关节。
生创精准医疗
2021年3月3日,据CDE官网显示,生创精准医疗申报的“宫血间充质干细胞注射液”申报临床获得受理,适应症为特发性肺纤维化。值得一提的是,这是国内首款获准临床的宫血来源干细胞治疗候选产品,也是第二款以“特发性肺纤维化”为适应的干细胞治疗候选产品。
麦迪森再生医学
2019年2月12日,据CDE官网显示,麦迪森再生医学的人原始间充质干细胞提交临床试验补充申请,用于造血干细胞移植后发生的急性和慢性移植物抗宿主病的治疗和预防。
奥克生物
2018年12月5日,奥克生物申报的干细胞创新药“人脐带间充质干细胞注射液”申报临床获得受理,用于治疗中重度溃疡性结肠炎。
得康生物
2021年8月31日,得康生物申报的生物制品1类新药“异体人源脂肪间充质干细胞注射液” (代码DK-001)申报临床获得受理,适应症为治疗“非活动性/轻度活动性腔内克罗恩病的成年患者的复杂肛周瘘”。
莱馥医疗
2023年6月16日,莱馥医疗自主研发的“人脐带间充质干细胞注射液”,正式获得CDE的药物临床试验批准通知。新适应症主要用于间质性肺病的治疗,这是继2021年莱馥医疗“人脐带间充质干细胞注射液”首个适应症特发性肺纤维化获批后斩获的又一新适应症。
兴瑞生物
2023年3月24日,据CDE官网显示,兴瑞生物提交的“新邦干细胞注射液”新药研究性(IND)申请获得受理,适应症为膝骨关节炎,干细胞的修复再生特性为膝骨关节炎的治疗开辟了全新的路径。
拓弘康恒
2023年6月12日,据CDE官网显示,拓弘康恒自主研发的“人源TH-SCO1细胞注射液”新药研究性申请(IND)获得临床默示许可,用于治疗慢性放射性直肠炎。该款人源TH-SCO1细胞注射液是一款注射用人脐带间充质干细胞,由拓弘康恒采用具有自主知识产权的细胞制备技术研发而成。此前,该产品已经获批两项适应症,分别用于治疗非活动性/轻度活动性克罗恩病肛瘘、复杂性肛瘘。
无锡华泰
2023年6月20日,据CDE官网,无锡华泰的“IHS002人脐带间充质干细胞”申报临床。该产品目前尚未披露更多信息,医麦客将持续跟踪报道。
爱姆斯坦
2022年1月30日,爱姆斯坦生物申报IMS001的IND。这是世界首次将胚胎干细胞来源的细胞用于人体全身给药的临床试验中,首个适应症是多发性硬化。
北科生物
2020年6月5日,据CDE官网显示,北科生物注射用注射用人脐带间充质干细胞新药临床试验申请获得受理。据悉该干细胞新药为国内首个针对治疗难治性系统性红斑狼疮的干细胞产品。
瑞风生物
2022年8月15日,根据CDE官网,瑞风生物申报的“HBG基因修饰的自体CD34+造血干细胞注射液”临床试验申请,已经获得受理,适应症为输血依赖型β-地中海贫血。RM-001利用CRISPR/Cas基因编辑技术永久性修饰γ-珠蛋白启动子,激活人体内天然存在的胎儿血红蛋白(HbF)的合成,持续缓解β-珠蛋白缺失导致的溶血性贫血症状,达到单次给药根治β-地中海贫血的目的。
邦耀生物
2022年8月16日,CDE官网显示,邦耀生物BRL-101自体造血干祖细胞注射液获得临床默示许可,适应症为β-地中海贫血(地贫),基于自主研发的造血干细胞平台(ModiHSC®)开发而成。
赛傲生物
2022年2月11日,CDE官网显示,正式审批通过赛傲生物提报的1类新药临床试验,人羊膜上皮干细胞注射液治疗造血干细胞移植后激素耐药型急性移植物抗宿主病申请。
仙荷医学
2021日3月12日,仙荷医学科技有限公司旗下的REGEND001细胞自体回输制剂新药研究性(IND)申请获得受理,用于治疗早、中期特发性肺纤维化。据悉该款干细胞新药是全球首个获批进入临床的针对于呼吸系统疾病的干细胞产品,其主要利用独特的肺组织再生修复机制发挥治疗作用,采用自体肺基底层上皮细胞帮助重建呼吸系统。
结语
随着近年国家政策、监管制度日趋完善,以及新技术的不断突破,当下我国干细胞疗法相较过去几十年中已经取得了巨大进步,颇有领跑全球的劲头。但与此同时,由于干细胞相关产品在细胞来源、类型、制备工艺等方面差异较大,其治疗机制和体内活性等相较传统药物更加复杂,所以干细胞在成药上也仍然面临一些挑战,包括干细胞的安全性、诱导效率、临床转化工艺探索、研发成本高等,都在一定程度上限制了干细胞治疗的发展。相信随着干细胞新技术的迭代,未来必将冲破这些局限性,成为解决众多临床未尽之需的重要主力军,为人类的医疗及其他行业带来跨时代的变革。
免责说明:本文来自“医麦客”,仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。



 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号