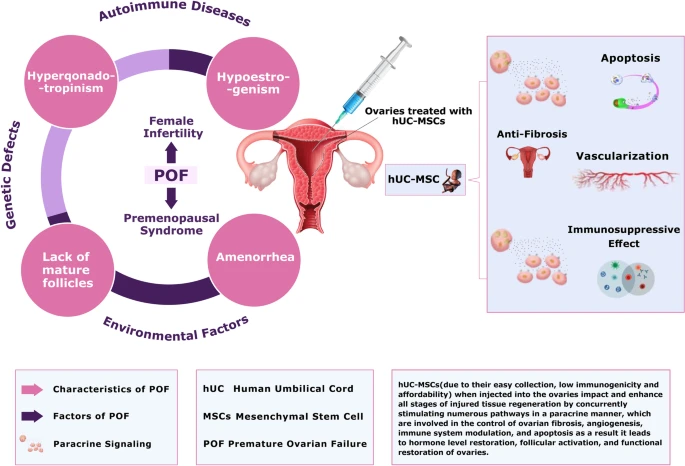
卵巢早衰 (POF) 影响1%的40岁以下女性,导致不孕。POF的临床症状包括低雌激素、缺乏成熟卵泡、高促性腺激素和闭经。POF可由遗传缺陷、自身免疫性疾病和环境因素引起。
POF的常规治疗成功率仍然有限。因此,一种创新的治疗策略,如使用人脐带间充质干细胞 (hUC-MSCs) 再生早产卵巢,可以成为一种选择。
为了总结其他研究和临床试验的所有理论框架,这篇评论文章重点介绍了脐带间充质干细胞治疗卵巢早衰的所有结果、优点和缺点。到目前为止,数据显示有关使用脐带间充质干细胞治疗卵巢早衰的有希望的结果。相对较低的免疫原性、多能性、多来源、经济实惠、生产方便、高效和供体/受体友好性等多种特性使脐带间充质干细胞成为治疗卵巢早衰的良好选择。
据报道,脐带间充质干细胞通过同时刺激旁分泌方式的众多途径来影响和增强受伤组织再生的所有阶段,这些途径参与控制卵巢纤维化、血管生成、免疫系统调节和细胞凋亡。此外,一些研究表明,干细胞治疗可以导致激素水平恢复、卵泡激活和卵巢功能恢复。因此,关于使用脐带间充质干细胞治疗卵巢早衰的所有现有结果鼓励研究人员进行进一步的临床试验。
介绍
卵巢是女性体内复杂而重要的生殖器官。多种因素会影响卵巢功能,导致女性不孕。卵巢的外层包含称为卵泡的独特结构。这些卵泡产生卵母细胞(未成熟卵),卵母细胞通过称为卵泡发生的过程成熟为可受精卵。
卵巢卵泡包括三类细胞:卵母细胞、卵泡膜和颗粒细胞。卵泡的生长和发育取决于卵泡刺激素 (FSH) 和黄体生成素 (LH) 受体,它们存在于颗粒细胞和卵泡膜细胞中。卵泡发生是一个精心计划和规范的过程。该过程涉及原始卵泡发育成初级卵泡、腔前卵泡和最终的窦卵泡。排卵发生在这个阶段之后(图1)。
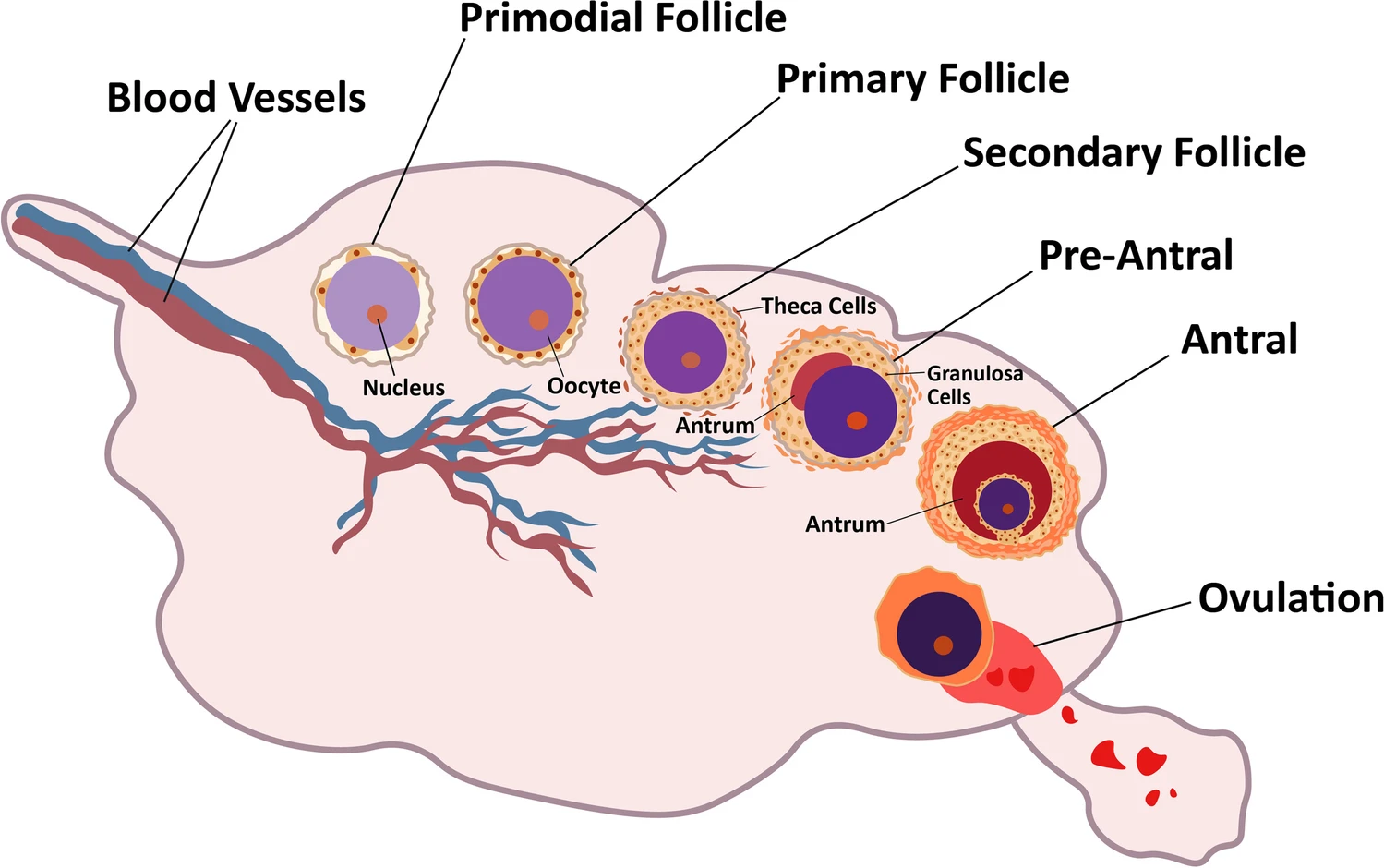
排卵发生在胃窦期之后
在女性的生育期,原始卵泡的数量是有限的。据说女性在储备耗尽时进入了生殖衰老或更年期。在女性的整个生育期中,只有大约400个卵泡会发育和排卵,而大部分卵泡永远不会发育。由于影响卵巢的各种生殖异常导致不适、月经不调、泌尿系统问题、不孕症和妊娠失败,卵巢可能会停止功能。其中,卵巢早衰 (POF)/原发性卵巢功能不全 (POI)、多囊卵巢综合征 (PCOS)、Asherman综合征、子宫内膜异位症和先兆子痫是最常见的女性生殖障碍。
卵巢早衰的病理生理学
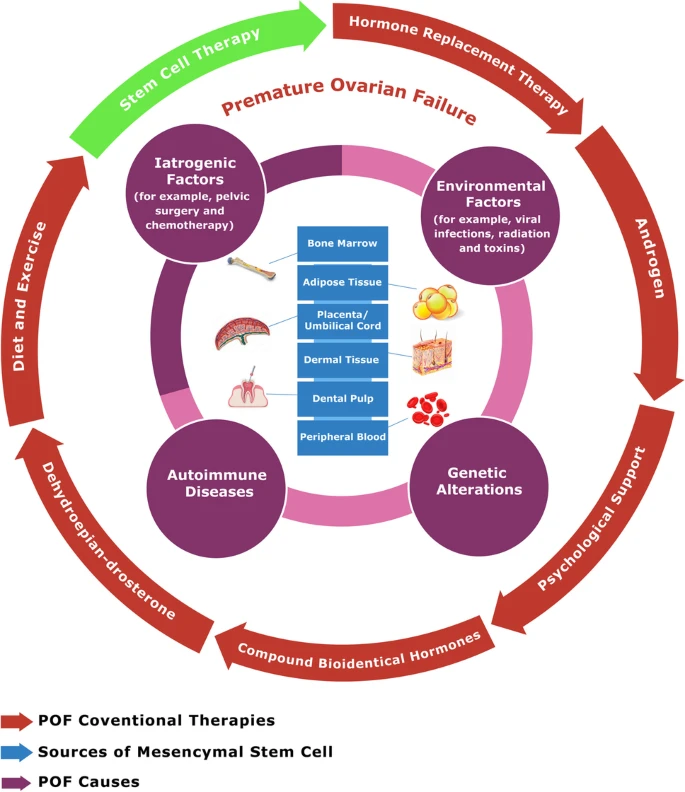
POF的主要原因包括医源性因素,如盆腔手术和化疗,环境因素,如病毒感染、辐射和毒素,自身免疫性疾病和抗卵巢抗体导致卵巢损伤,以及遗传变化,如点突变,涉及X染色体或常染色体的染色体失衡(图2)。
卵巢早衰的常规治疗方法
由于POF的复杂性,已经提出了几种治疗方法。然而,它们都没有显示出足够成功地作为可靠的一线替代品。POF的治疗包括激素替代疗法、雄激素、咨询、合成的生物同质性激素、脱氢表雄酮、捐赠的卵母细胞、运动和饮食以及干细胞治疗(图2)。
与卵巢早衰常规治疗相关的风险
POF病因复杂,主要有常染色体遗传异常、X染色体异常、免疫紊乱、酶缺乏等。在年轻人中,由化疗药物引起的POF更为明显。激素替代疗法 (HRT) 是最普遍的POF治疗方法。另一方面,HRT在提高生育率方面的作用仍有争议。应使用替代疗法来减轻与POF相关的症状和风险,因为HRT被认为对有卵巢癌或乳腺癌病史的女性是危险的;它还会增加血栓、癌症、中风和其他并发症的风险。对于大多数POF女性来说,捐卵是最后也是最有希望的选择。然而,捐赠的卵子供应有限,接受这些卵子的患者将无法生育自己的亲生孩子。
因此,专家们正在寻找更有效和创新的POF治疗方法。由于与用于治疗POF和不同类型不孕症的HRT疗法相关的不良反应,科学家们正在转向替代疗法,例如干细胞疗法,以治疗POF和其他类型的不孕症。间充质干细胞移植似乎是一种潜在的治疗选择。
干细胞疗法治疗卵巢早衰
最近,SC疗法被提议作为治疗多种疾病的潜在替代品,并被归类为再生医学。干细胞可以分化和自我更新来修复和恢复受损的组织或细胞。干细胞是在胚胎、胎儿和成年生命阶段发现的未特化、未分化的细胞。
干细胞可能存在于人体的许多部位,并根据它们的来源进行分类,如皮肤和脂肪、脐带、羊水、胎盘和骨髓。一些主要的干细胞类型,如ESCS:胚胎干细胞;MSCs:间充质干细胞;SSCs:精原干细胞;iPSCs:诱导性多能干细胞已全部用于干细胞治疗不孕症。
间充质干细胞 (MSC)
间充质干细胞是从基质组织中提取的多能间充质基质细胞,具有可塑性粘附、自我更新和多向分化能力。许多专家认为,移植间充质干细胞(MSCs)是最有效、最成功的细胞治疗方法。这些细胞通过同时刺激多种途径(营养、旁分泌、免疫调节和分化)来影响和增强受伤组织再生的所有阶段。
MSCs起源于人体的多个部位,包括骨髓、羊膜、羊水、牙组织、子宫内膜、月经血、肢芽、外周血、胎膜和胎盘、皮肤和包皮、唾液腺、沃顿氏胶、亚羊膜脐带内膜和滑液(图2)。
MSCs 通过直接分化和旁分泌作用提供治疗优势,后者现在被认为是最关键的治疗机制。
多项人体试验已证明间充质干细胞 (MSC) 可恢复卵巢功能并为女性不孕症提供健康治疗。从各种组织和器官(包括胎盘、骨髓、脂肪组织和子宫内膜)中提取的MSCs可促进卵泡发育并改善卵母细胞的发育和质量、排卵和生育能力,作为POF的治疗方法。
人脐带作为人脐带间充质干细胞 (hUC-MSCs) 的来源
人脐带是MSCs的良好来源。与骨髓干细胞不同,从人脐带中提取的MSCs采集起来更快、更无痛。在脐带的维管组织和沃顿氏胶质中也发现了MSCs。这些细胞在组织修复、免疫反应调节和抗癌能力方面表现出与骨髓细胞相同的三重活性。其他多能或胚胎干细胞可以使用 hUC-MSC 作为营养来源。
UC-MSCs可以道德上可接受的和非侵入性的方式获得,并且可以在扩展后产生大量的UC-MSCs。脐带 (UC) 包含一条脐静脉 (UCV) 和两条脐动脉 (UCA),均嵌入沃顿氏胶质 (WJ) 内,沃顿氏胶质 (WJ) 是一种被羊膜上皮覆盖的特定粘液结缔组织(图3)。
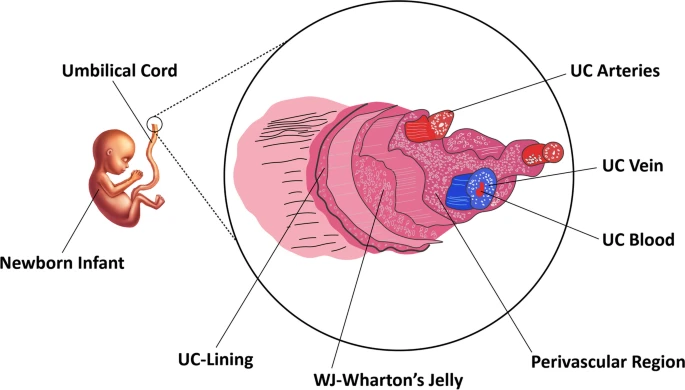
hUC-MSC可来源于脐带的白色肉质,称为沃顿氏胶质 (WJ- MSC )、脐带血 (UC-MSC)或人脐带血管周围干细胞 (HUCPVC ) 。尽管UC血 (UCB) 和脐带 (UC) 通常在分娩后作为医疗废物丢弃,但它们提供了丰富的干细胞来源。从UCB中鉴定出至少三种类型的干细胞,包括内皮祖细胞、间充质干细胞 (MSC) 和造血干细胞 (HSC)。已从许多脐带隔室中分离出MSC。MSCs已从脐带血中分离出来,在沃顿氏胶和脐静脉内皮下:血管周围区、羊膜下和血管间位点。UC-MSC相对于其他MSC来源的优势是非侵入性检索、现成使用和高丰度。
人脐带间充质干细胞治疗的优势
脐带在出生后通常作为医疗废物丢弃;因此,由于该程序是非侵入性的,因此排除了对其访问的道德担忧。
UC-MSC与其他来源的MSC 一样,具有独特的自我更新能力,同时保持其多能性(发育成骨细胞、脂肪细胞、软骨细胞、肝细胞和神经元的能力)。
干细胞通过旁分泌作用而不是发育成特定细胞来增加卵巢功能。
UC-MSCs的免疫调节特性也引起了人们的兴趣。UC-MSCs现在被强调为一种潜在的适应性再生医学和免疫治疗策略。UCMSCs几乎没有什么特殊的特性可以维持,即快速自我更新、低肿瘤风险、低免疫排斥几率、较少伦理问题、无创无痛采集以及易于批量生产。
人脐带间充质干细胞的旁分泌作用
hUC-MSCs具有高细胞因子分泌特征,使其增殖更快、分化更有效且免疫原性低。其中包括白细胞介素 (IL)、集落刺激因子 (CSF)、肿瘤坏死因子 (TNF)、干扰素 (IFN)、趋化因子和 TGF。这些细胞因子参与 UCMSC 的归巢、抗炎、迁移、抗促血管生成和凋亡途径。几项研究表明,这些UCMSCs可以通过产生细胞因子和其他参与增殖和组织形成的因子来修复受损的卵巢功能。以下是对干细胞被认为具有的基本作用机制的拟议解释(图4)。
据报道,用hUC-MSCs处理的卵巢显示,在循环愈合过程中,卵巢生态位中的血管形成增加,并且可能有助于血管生成背景下的卵巢恢复。
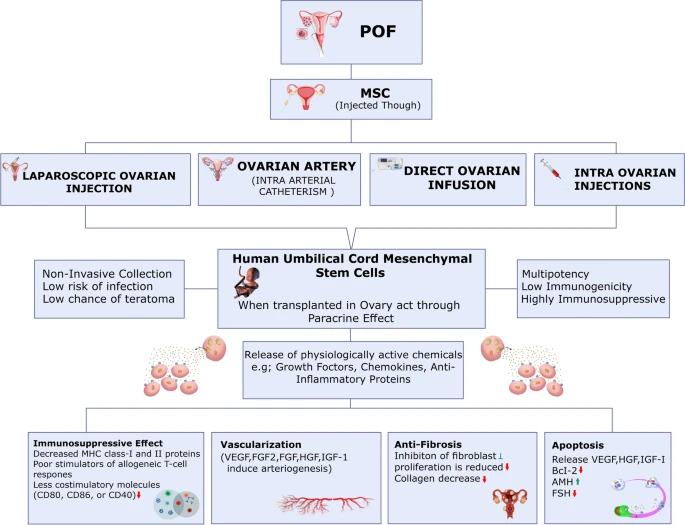
流程图表示如何通过各种方法注射MSCs来治疗卵巢早衰,
因此MSCs通过旁分泌信号发挥作用,并参与控制卵巢纤维化、血管生成、免疫系统调节和细胞凋亡。
人脐带间充质干细胞的免疫抑制作用
hUC-MSC是MSC的丰富来源,可显示干细胞特异性标记物,可分化为各种类型的中胚层细胞,用于免疫反应调节和组织修复。 MSCs已被证明通过控制巨噬细胞、细胞因子和调节性T淋巴细胞的数量在卵巢生态位中表现出免疫调节能力。MSC与先天性和适应性免疫系统的免疫细胞相互作用,以显示免疫调节特性。MSC控制T细胞的生长和功能。MSCs仅在受限的靶组织中发挥免疫调节功能;它们没有系统性影响。因此,它们不会全身性地抑制免疫系统。
此外,据报道,hUC-MSC可通过调节 (Th1/Th2) T-helper-1和T-helper-2细胞因子的比例以及 (NK) 自然杀伤细胞的数量来恢复POF小鼠的卵巢功能。另外,MSCs具有免疫调节作用,使其成为免疫介导的POF的前瞻性治疗选择。因此,需要更全面的过程来提高MSC的治疗效果,并为其临床应用奠定基础。
使用人脐带间充质干细胞治疗卵巢早衰的临床试验
第一项临床研究是在使用骨髓 (BM) 的MSCs的人身上进行的,通过髂嵴抽吸进行细胞收集、干细胞分离和体外培养方法。
Gupta等人报道了一项干细胞疗法,一名45岁的围绝经期妇女生下了一名重2.7公斤的女婴。
对10名POF年轻女性采用类似技术的阳性结果显示,两名患者恢复了月经,并成功怀孕。
与另一项针对30名POF女性(18-40岁)的研究相似,导致一次怀孕并改善了卵衰症状。
根据研究,BMDSC可促进卵巢血管形成、基质细胞增殖和细胞凋亡,从而促进人类和小鼠的卵泡生长。基于这些知识,一个团队对17名POF女性进行了未来的试点研究,以检查自体干细胞卵巢移植 (ASCOT) 对卵巢储备的影响。结果,完成了6次妊娠和3个不同的新生儿,81.3%的女性卵巢功能生物标志物(AMH和AFC)得到改善。
值得注意的是,许多涉及POF女性的随机对照试验 (RCT) 正在测试全球多个额外的干细胞来源。根据 ClinicalTrials.gov的数据,目前全球有21项临床研究使用干细胞治疗POI/POF患者。
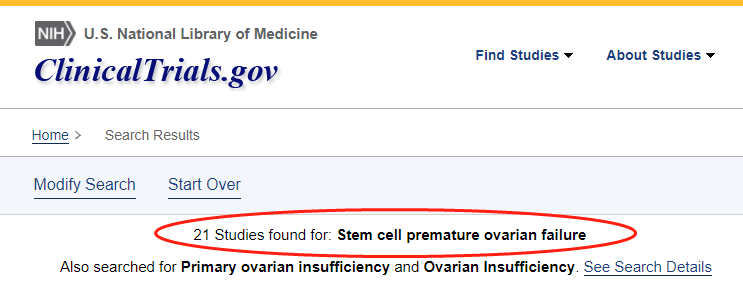
在这21项研究中,有7项涉及移植人脐带间充质干细胞。将UCMSCs移植到POI/POF患者体内的临床试验仍在进行中,还需要更多的研究来确定UCMSCs是否有效治疗POI/POF。
一项研究表明,UCMSC对生殖的影响可能是由卵巢血管生成的增加引起的,这会促进颗粒细胞增殖以及卵泡的产生和发育。4例患者采用UCMSC疗法(卵巢内注射UCMSCs1-3次)体外受精胚胎移植后怀孕,后代发育正常。这种治疗成功地恢复了61名女性的卵巢功能,而没有引起严重的不良事件。
有趣的是,研究表明,间充质干细胞有望治疗多种疾病。关于MSCs对POF的影响正在进行临床和临床前研究。根据初步研究结果,在临床环境中全身施用MSCs具有显着的治疗潜力,将为POF患者带来希望。由于已经完成的几项成功的临床试验,MSCs在POF中的临床应用将很快实现。
临床研究可以显着改善卵巢功能障碍的治疗。有超过300项针对MSC治疗的临床试验。根据FDA.gov上列出的1050多项临床研究,多能间充质基质细胞 (MSC) 正在研究几乎所有可以想象到的治疗应用。许多公司已经商业化或正在商业化基于MSC的治疗。然而,大多数MSC疗法未能达到其临床阶段的主要疗效最终目标。
结束语
许多夫妇因卵巢早衰导致不孕而感到悲伤和绝望。由于这种疾病的复杂性,没有建议采用单一疗法;相反,已经使用了并发症较少的联合治疗。虽然不是特别有效,但POF患者通常使用激素疗法来控制症状。在过去的十年中,许多具有治疗前景的干细胞类型已被用于治疗POF。大多数研究证明了干细胞治疗卵巢早衰的有效性,有证据表明这些细胞可能发育成卵巢卵泡并恢复卵巢功能。
大量研究表明,人间充质干细胞在POF患者中具有良好的临床转化和应用潜力,可以从根本上恢复卵巢功能。
参考资料:Umer, A., Khan, N., Greene, D.L. et al. The Therapeutic Potential of Human Umbilical Cord Derived Mesenchymal Stem Cells for the Treatment of Premature Ovarian Failure. Stem Cell Rev and Rep 19, 651–666 (2023). https://doi.org/10.1007/s12015-022-10493-y
免责说明:本文 仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信