神经干细胞 (NSC) 在神经再生中具有独特的作用。神经干细胞移植的细胞疗法是治疗神经系统疾病的一种有前途的工具。然而,这些细胞的衍生和治疗应用仍然存在许多问题和争议。在这篇综述中,我们总结了神经干细胞的不同来源及其衍生方法,包括从原代组织直接分离、从多能干细胞分化和从体细胞转分化。
我们还回顾了神经干细胞移植治疗各种神经缺陷和损伤的临床进展。最后,我们讨论了神经干细胞衍生的潜在优化策略,并在不久的将来对神经干细胞移植的疗法的临床转化提出了紧迫的挑战。
事实
- 神经干细胞是一种很有前途的治疗与神经系统相关疾病的方法,因为它们分泌可溶性因子并分化为神经元、星形胶质细胞和少突胶质细胞。
- 利用最近的技术进步,可以从三种不同的来源获得神经干细胞:从原代组织直接分离、从多能干细胞分化和从体细胞转分化。
- 基于神经干细胞移植的细胞疗法用于治疗动物模型和临床试验中的各种神经缺陷和损伤已被广泛研究。
开放式问题
- 哪种神经干细胞推导策略对临床翻译最有效和最安全?
- 神经干细胞移植方法如何从临床前研究转化为临床试验?
- 在不久的将来,基于神经干细胞的疗法的临床转化有哪些优化策略和紧迫挑战?
神经干细胞移植在临床中面临的问题有哪些?
神经系统疾病是一种难治性疾病,可导致感觉丧失、运动功能丧失和记忆力减退,并直接威胁患者的生命。目前,这些疾病的致病因素及其发病机制尚不清楚。传统药物治疗用于延缓疾病进展,不能恢复功能或再生组织。最近的研究表明,神经干细胞(NSCs)的移植是治疗与神经系统相关的疾病、神经细胞再生和损伤部位微环境恢复的一种很有前景的治疗方式(图1)。
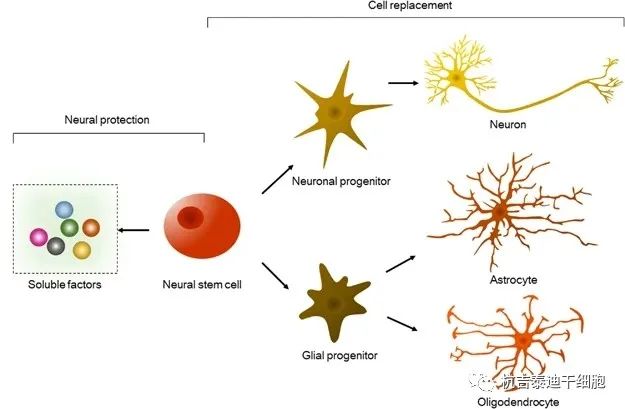
神经干细胞分泌可溶性因子,包括神经营养因子、生长因子和细胞因子,从而保护现有神经细胞免受原位损伤。此外,它们通过定向祖细胞分化成神经元、星形胶质细胞和少突胶质细胞,以替代丢失的神经细胞。神经保护或细胞替代均可通过神经再生帮助急性或慢性损伤后的神经功能恢复。
细胞来源是使神经干细胞在临床治疗中应用必须解决的第一个问题
因为充分移植所需的细胞剂量非常高。
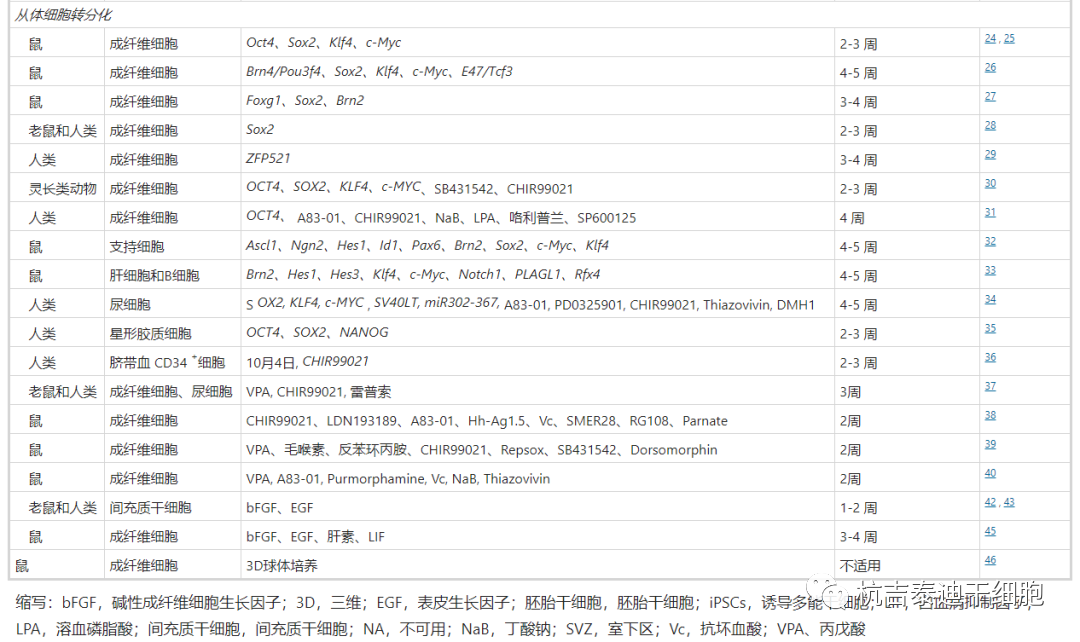
利用最近的技术进步,可以从三种不同的来源获得神经干细胞,包括从原代组织直接提取、从多能干细胞分化和从体细胞转分化(图2和表1)。
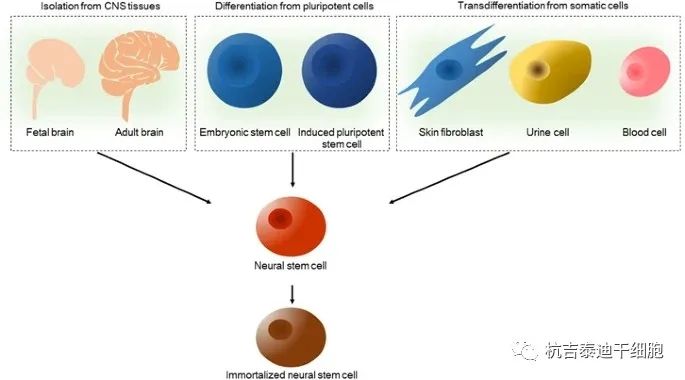
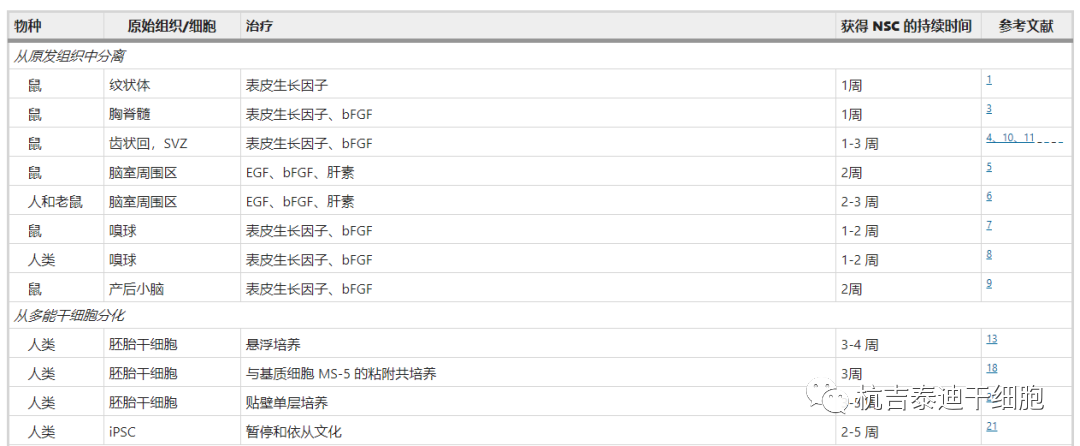
分离和生成神经干细胞的策略
从原代组织中分离和培养神经干细胞
细胞分离和细胞培养技术的建立导致了有利的实验方法的发展,并为NSC研究确定了丰富的细胞来源。
1992年,Reynolds和Weiss从成年小鼠大脑的纹状体中分离出NSC,并报道了首次使用表皮生长因子(EGF)在体外诱导 NSC增殖。两年后,他们发现小鼠大脑的室管膜下区是体内NSCs的来源。
多能干细胞分化为神经干细胞
多能干细胞,包括胚胎干细胞 (ESC) 和诱导多能干细胞 (iPSC),可以通过分化产生所需的细胞,这是原代细胞分离的有吸引力的替代方案。一般来说,多能干细胞的神经分化方案可分为两种主要途径:胚状体 (EB) 形成和单层培养。
体细胞转分化为神经干细胞
转分化,也称为谱系重编程,最初是由Selman和Kafatos在1974年创造的。在此过程中,一种成熟的体细胞在不经历中间多能状态的情况下转化为另一种成熟的体细胞。该过程主要由谱系特异性转录因子 (TF) 的外源表达和化合物诱导。
神经干细胞移植治疗神经系统疾病进展
神经退行性疾病
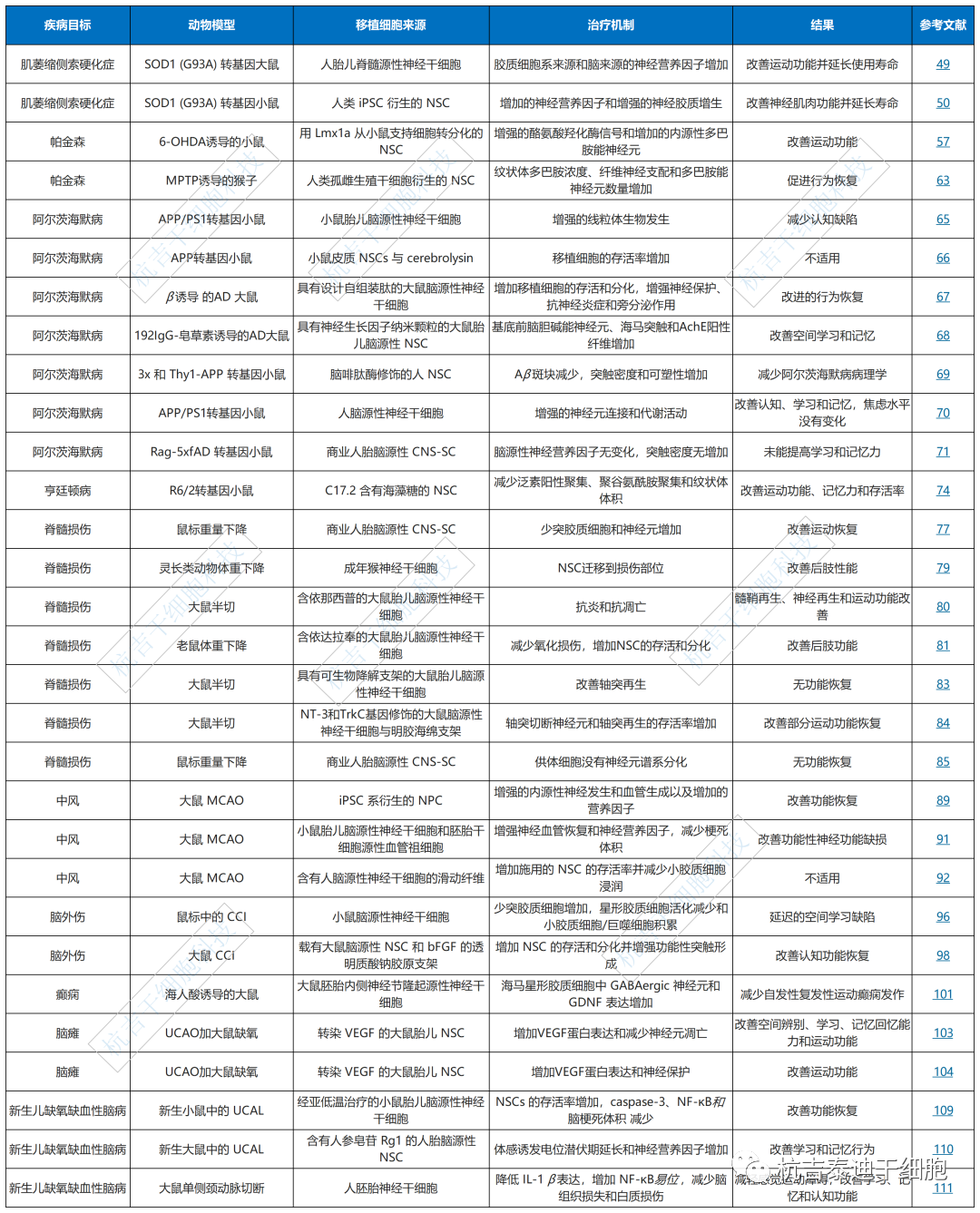
神经退行性疾病是由大脑或脊髓中的神经或胶质细胞缺陷引起的,导致记忆力下降、认知障碍、痴呆或肢体运动障碍,主要包括肌萎缩侧索硬化症(ALS)、帕金森病(PD)、阿尔茨海默病( AD) 和亨廷顿病 (HD)。
渐冻症(ALS):ALS的特点是大脑皮层、脑干和脊髓中的运动神经元退化和丧失,从而导致肌肉萎缩、虚弱,并最终在5年内死亡。NSC分泌胶质细胞系衍生的神经营养因子和脑源性神经营养因子,在ALS转基因大鼠模型中诱导运动神经元的再生。
帕金森(PD):PD是一种以黑质致密部和纹状体末端的多巴胺神经元丧失为特征的疾病。在毒素诱导的PD动物模型中,移植的人类NSC刺激大鼠星形胶质细胞去分化和外源性生长因子的分泌,从而通过调节病变微环境抑制小胶质细胞的活化并减缓PD进展。
阿尔茨海默病(AD):AD的特征是可溶性和不溶性淀粉样蛋白β肽水平升高。
据报道,AD患者的海马神经元线粒体水平降低。将外源性神经干细胞移植到转基因AD小鼠中会导致线粒体数量和线粒体相关蛋白的表达显着增加,以及小鼠认知功能的改善。
亨廷顿病(HD):HD是一种常染色体显性遗传病,可诱发尾状核萎缩,其特征是不自主的舞蹈动作、认知障碍和情绪障碍。临床发现NSC联合海藻糖的脑内移植不仅可以减轻多聚谷氨酰胺聚集形成并减少纹状体体积,而且还可以延长HD转基因小鼠模型的寿命。
脊髓损伤(SCI):脊髓损伤 (SCI) 是一种严重的身体损伤,通常会导致严重的运动功能丧失和继发性损伤。
SCI尚无有效的常规治疗方法,但在SCI小鼠模型中移植神经干细胞可显着改善运动功能恢复,从而表明神经干细胞可以在体内存活、分化和改变早期慢性损伤部位的微环境。
中风(Stroke):中风是一种急性脑血管疾病,包括缺血性和出血性中风。据报道,移植的小鼠iPSC衍生或人类胎儿衍生的NSC系可在缺血性和出血性中风动物模型中提供神经营养因子并增加血管生成和神经发生。
创伤性脑损伤(TBI):创伤性脑损伤的主要机制分为局灶性脑损伤和弥漫性脑损伤,分别对应接触损伤类型和加速/减速损伤类型。TBI极有可能导致认知和记忆缺陷以及运动障碍。
先前的研究得出结论,NSCs可以稳定TBI后的皮质微环境。将小鼠脑源性NSC移植到脑损伤小鼠体内可有效防止星形胶质细胞活化和小胶质细胞/巨噬细胞积聚,同时增加少突胶质细胞并修复和维持正常的神经元功能。载有bFGF的透明质酸钠胶原支架可促进移植的大鼠神经干细胞的存活和分化,并促进功能性突触形成以修复大鼠的创伤性脑损伤。
癫痫(Epilepsy):癫痫是由于中枢神经系统兴奋和抑制失衡导致的脑神经元异常放电;这种不平衡导致短暂的脑功能障碍,主要与离子通道神经递质和神经胶质细胞的变化有关。近30%的颞叶癫痫 (TLE) 患者对抗癫痫药物耐药。
目前的报告表明,NSC移植可以抑制自发性癫痫发作。当移植到海马的癫痫部位时,外源性NSC会产生一种特定类型的神经元,该神经元合成抑制性神经递质γ-氨基丁酸和分泌抗惊厥因子的星形胶质细胞,从而减缓TLE引起的认知和情绪功能障碍。
脑瘫(CP):脑性麻痹 (CP) 是一组出现在儿童早期的永久性运动障碍,这是由于发育中的中枢神经系统形成非进行性病变所致。目前,CP治疗包括许多措施,但这些治疗方法都不能治愈CP患者。
近年来,人们对神经干细胞移植治疗脑瘫的安全性和有效性进行了评估。基于目前的研究,移植血管内皮生长因子的NSCs可以部分减缓脑损伤,并对缺氧介导的CP新生大鼠具有神经保护作用,从而为CP治疗提供了一种新的潜在策略。
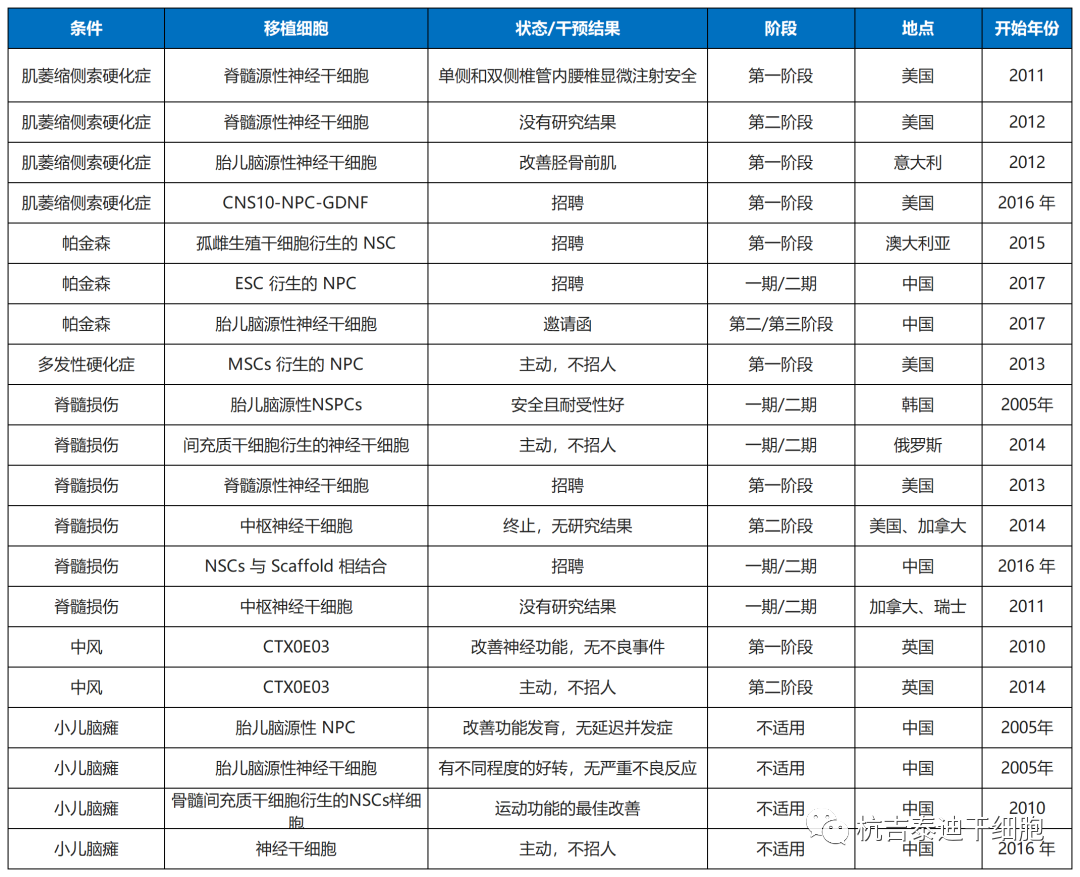
目前神经干细胞移植应对的主要问题
- 首先,临床治疗必须遵守标准化方案。因此,必须为治疗程序建立详细而有效的标准,包括干细胞类型、移植时间和细胞剂量。NSC的纯度是重中之重,需要解决和批准,因为其他细胞的污染可能会导致意想不到的副作用。
- 其次,用作种子的干细胞必须在体外和体内都经过验证是安全的。为此,我们建议对每批制造的NSC产品在小鼠体内进行深度测序和检查肿瘤形成效力。
- 第三,体内NSCs的低存活率和适度的治疗效果是仍有待解决的重大问题。此外,干细胞治疗的潜在机制仍不清楚,因此需要进一步的研究。相关领域的进一步基础研究可能有助于解决上述问题。最后,需要先进的成像技术来监测体内移植的神经干细胞的生理状态,以排除致瘤性和其他缺陷。
结论和观点
神经干细胞在治疗神经系统疾病方面表现出很大的可塑性,可被诱导分化为各种类型的成熟神经细胞,包括神经元、星形胶质细胞和少突胶质细胞。在特定条件下,神经干细胞具有广泛的分化库,甚至可以产生非外胚层细胞,包括造血细胞和骨骼肌原细胞。
此外,神经干细胞分泌神经营养因子,改善病变微环境,从而为病理修复创造适当条件。上述发现证实了神经干细胞移植在神经系统疾病应用中的重要价值。神经干细胞移植的治疗效果可以通过辅助药剂、基因改造、三维移植或辅助细胞进一步提高,这可能会提高细胞的存活率和分化成特定类型的细胞。
最初,神经干细胞只能从胚胎大脑中获得,因此,来源有限、分离技术问题和低纯度阻碍了基于NSC的细胞疗法的进展。此外,还有伦理和道德问题。目前,新兴技术不断改进可用于获得神经干细胞的方法,特别是胚胎干细胞的鉴定和诱导多能干细胞的开发,从而能够获取大量神经干细胞,促进神经干细胞的基础研究。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信