阿尔茨海默病 (AD) 是最常见的老年痴呆类型,2019年导致超过121,499人死于AD,使AD成为美国的第六大病因。AD是一种进行性神经退行性疾病,其特征是记忆力下降,行为障碍会影响一个人独立运作的能力,最终导致死亡。
近年来各类干细胞治疗阿尔茨海默病的临床试验

尽管对AD的病理生理学的理解取得了进展,但该疾病的治疗选择是有限的。近年来,利用干细胞进行临床前研究和临床试验的突破为研究和治疗AD患者的新视角铺平了道路。干细胞在生物体的整个生命周期中具有自我更新、增殖、分化和产生分化细胞的独特能力。由于这些特性,这些细胞被认为是细胞替代疗法的最合适选择。
迄今为止,已经描述了几种具有不同差异能力的干细胞来源。全能细胞起源于一两次合子分裂后的卵裂球,具有产生所有组织的能力,最终形成整个生物体,包括额外的胚胎组织。多能干细胞可以产生所有三个胚层,即内胚层、外胚层和中胚层。胚胎干细胞 (ESCs),源自内细胞团 (ICM) ,以及诱导多能干细胞 (iPSCs),可通过体细胞的核重编程在体外产生 (图1),是多能干细胞的显著例子。
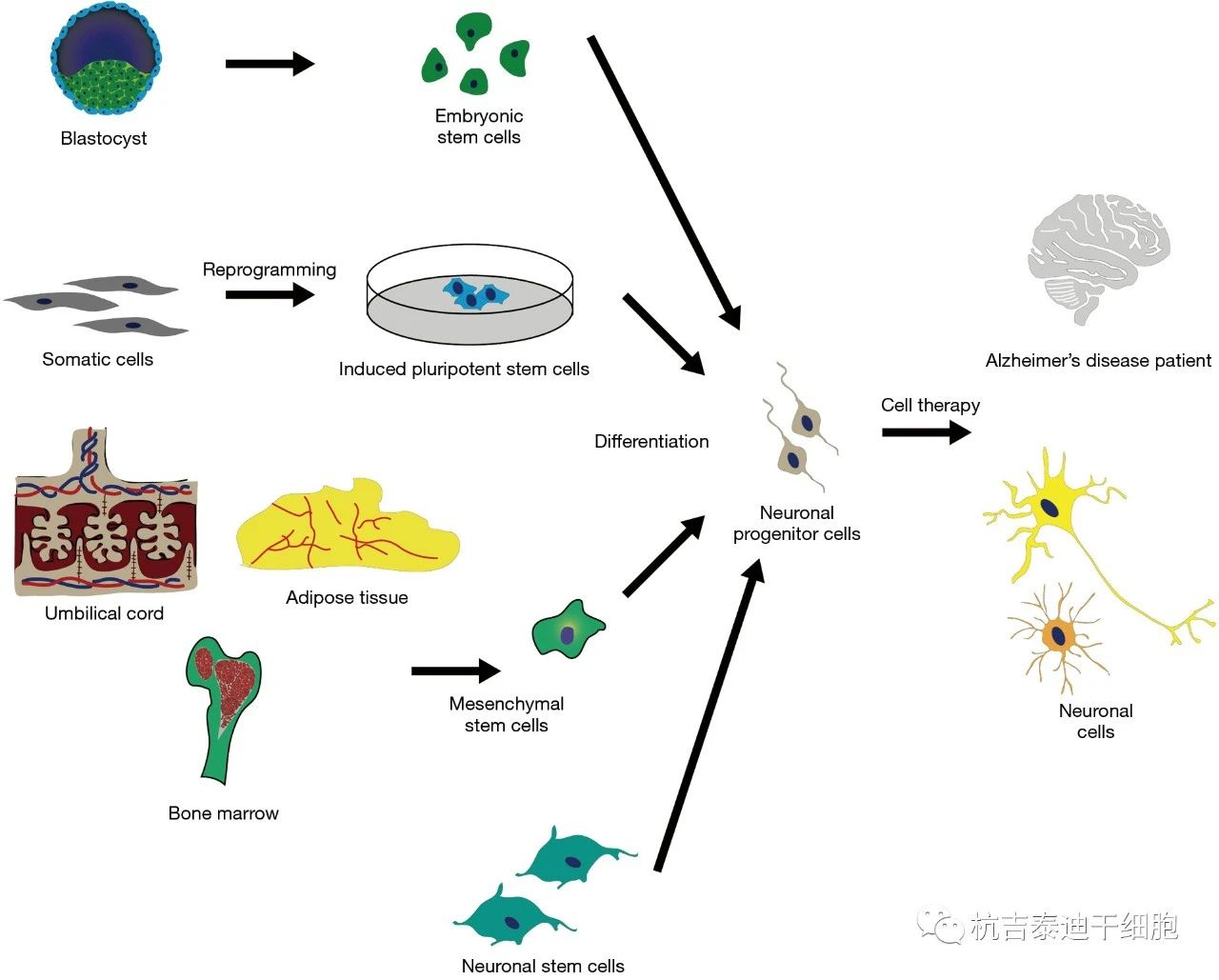
近年来各类干细胞治疗阿尔茨海默病的临床试验
在当前的文章中,我们回顾了关于不同来源的干细胞治疗阿尔茨海默病的最新进展,并在国家和国际登记处提供了每个可用临床试验的综合列表。最后,我们讨论了由AD病理学和技术限制引起的阻碍干细胞技术从实验室向床边转变的缺陷。我们的研究结果强调需要增加临床试验,以揭示移植细胞的作用方式和潜在的治疗机制,以及控制再生和神经元微环境的分子机制。
胚胎干细胞与神经干细胞治疗阿尔茨海默症的临床试验
ESC在体外具有无限增殖寿命,同时还具有在体内产生任何成体细胞的能力。限制胚胎干细胞在临床试验中使用的障碍包括它们的纯化和保存过程、分离细胞的多能性验证、胚胎体形成、它们的致瘤能力以及使用人类胚胎干细胞 (hESCs) 产生的伦理影响源于植入前胚胎。然而,它们作为AD啮齿动物模型中细胞移植来源的作用已被广泛研究。
胚胎神经干细胞也被研究作为AD小鼠模型中治疗细胞的另一种可能来源。神经干细胞是多能神经前体,可在体外和体内分化成神经元、星形胶质细胞和少突胶质细胞。已经提出了解释神经干细胞可能的疾病改善作用的不同机制,包括神经血管损伤修复、通过与小胶质细胞相互作用的免疫调节、神经元替代、神经递质补充、促进突触可塑性和细胞存活的神经营养支持。神经干细胞可以分化并产生成熟的神经元(直接神经发生)或首先分化成神经NPC(间接神经发生)。将胚胎小鼠神经干细胞移植到APP/PS1小鼠海马中后,可诱导增强突触修复和保护基底前脑中的胆碱能神经元。
测试这些类型干细胞的临床试验仅记录在中国临床试验注册中心(表格1)。
表格1:神经干细胞治疗阿尔茨海默病症患者的临床试验
| 干涉 | 剂量[n]/途径 | 临床阶段/标识符 | 数量/条件 | 地位 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| 人神经干细胞 | (I)低剂量[10]/鼻内; (II)中等剂量[10]/鼻内;(III)高剂量[10]/鼻内; (IV) 安慰剂[10]/鼻内 | NA/ChiCTR2000028744 | 40/AD诊断;50-75岁;MMSE 10–20;Hachinski缺血评分改善≤4分;汉密尔顿精神抑郁量表≤10;Fazekas 量表 ≤2 | 尚未招募 | 不适用 | ( 61 ) |
| 人神经干细胞 | (I) 低剂量[9]/鼻内; (II)中等剂量[9]/鼻内; (III)高剂量[9]/鼻内; (IV) 安慰剂——生理盐水[9]/鼻内 | NA/ChiCTR2000039011 | 36/可能公元;50-75岁;MMSE 5-20;Hachinski缺血评分≤4;GDS≤10;Fazekas量表≤2;MTA分数≥2 | 尚未招募 | 不适用 | ( 62 ) |
| 自体 hNSC | 不适用 | NA/ChiCTR-ONC-17014171 | 30/AD诊断;40-80岁;无血液、肝脏、肾脏或胸部病变 | 未经伦理委员会批准 | 不适用 | ( 63 ) |
间充质干细胞和造血干细胞治疗阿尔茨海默病的临床试验
在不同的成体干细胞系中,间充质干细胞和造血干细胞很容易获得,因此已成为最广泛研究的可能的AD疗法。间充质干细胞是分级的出生后干细胞,能够自我更新并保持多种分化潜能。间充质干细胞可以从多种来源中分离出来,可以分化成多种类型的组织,具有高扩增能力和低免疫原性和致癌潜力。
- 关于它们在AD病理学中的作用,据报道,间充质干细胞通过释放神经营养因子来增强神经发生,增强Aβ清除,通过上调IL-10等神经保护细胞因子来改变先天性和适应性免疫细胞反应,同时减少促炎细胞因子的量TNF-α和IL-1β。还观察到β-淀粉样蛋白沉积减少和小胶质细胞吞噬活性增加。
已经有多项临床研究检查了hUC-MSCs在AD患者中可能的治疗益处。表2)。
表2:脐带、羊膜和胎盘间充质干细胞治疗阿尔茨海默病患者的临床试验
| 干涉 | 剂量[n]/途径 | 临床阶段/标识符 | 数量/条件 | 地位 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| 人脐带间充质干细胞 | (一)低剂量:3×106个细胞/脑[3]/IC;(二)高剂量:6×106 个细胞/脑[6]/IC | I期/NCT01297218和I、IIa 期/NCT01696591 | 9/可能AD;>50岁;K-MMSE 10–24;正向PIB-PET | 完全的 | 无严重不良事件;无剂量限制性毒性。K-MMSE变化:低剂量-9.5±0.7;高剂量-8.4±5.6。ADAS-Cog变化:低剂量20.0±9.9;高剂量8.6±13.1 | ( 79 – 81 ) |
| 人脐带间充质干细胞 | 第1阶段:(I)低剂量:1×107个细胞/脑[3]/ICV,3次输注;(II)高剂量:3×107个细胞/脑[6]/ICV,3次输注。第2阶段:(I)高剂量:3×107个细胞/脑[24]/ICV,3次输注;(II)安慰剂(生理盐水2mL)[12]/ICV,3次输注 | I期、IIa期/ NCT02054208 | 46/可能公元;50-85岁;K-MMSE 18-26;阳性 PIB-PET 或 florbetaben PET | 完全的 | 第一阶段结果:输注后出现短暂发热和脑脊液白细胞增多(9 名患者)。CSF 生物标志物:注射后 1 天,t-tau、p-tau、Aβ42 减少,MSC 标志物增加。K-MMSE变化(12周):低剂量0.0±2.0;高剂量0.7±1.6。ADAS-Cog变化(12周):低剂量0.7±4.0;高剂量2.3±5.0 | ( 82 , 83 ) |
| 人脐带间充质干细胞 | 不适用 | I期、IIa期/ NCT03172117 | NCT02054208的主题 | 招聘 | 不适用 | ( 84 ) |
| 人脐带间充质干细胞 | 不适用 | 不适用/ NCT04954534 | 在NCT02054208中接受安慰剂治疗的受试者 | 尚未招募 | 不适用 | ( 85 ) |
| 人脐带间充质干细胞 | 0.5×106个细胞/kg [30]/IV,8次输注 | 一、二期/ NCT01547689 | 30/可能AD;50-85岁;最小均方误差 3–20 | 未知 | 不适用 | ( 86 ) |
| 人脐带间充质干细胞 | (I)0.5×106个细胞/kg/IV,8次输注; (II)安慰剂(生理盐水)/IV,8次输注 | 一、二期/ NCT02672306 | 16/可能患有 AD 或混合性痴呆;50-85岁;最小均方误差 10-26;胆碱酯酶抑制剂或重酒石酸卡巴林胶囊治疗 | 未知 | 不适用 | ( 87 ) |
| 人脐带间充质干细胞 | 1×107细胞 [6]/IV,4次输注 | 一期/ NCT04040348 | 6/AD 或可能 AD;50-85岁;MMSE 20-26;淀粉样蛋白 PET 或 CSF Aβ42 阳性 | 招聘 | 不适用 | ( 88 ) |
| 人羊膜和 UC-MSC | 静脉注射、鼻内、雾化器取决于患者情况 | 一期/ NCT03899298 | 5,000/多种健康状况;>18岁 | 尚未招募 | 不适用 | ( 89 ) |
| 人羊膜和 UC-MSC | 路线取决于患者状况 | 一期、二期/ NCT04684602 | 5,000/多种健康状况;>18岁 | 招聘 | 不适用 | ( 90 ) |
| 人胎盘 MSC (CB-AC-02) | 第1阶段:(I)第1组:2×108个细胞/IV,1次注射;(II)第2组:2×108个细胞/IV,注射2次。第2阶段:(I)第1组(K-MMSE20-26):2×108 个细胞/IV,2次注射;(II) 第2组 (K-MMSE10–19):2×108个细胞/IV,注射2次;(III) 安慰剂[12]/ICV,2次注射 | 一、二期/ NCT02899091 | 24/可能公元;>50岁;最小均方误差 10-26;淀粉样蛋白 PET 阳性;MRI 或 PET 结果提示 AD | 招聘 | 不适用 | ( 91 ) |
胎盘干细胞治疗阿尔茨海默病的临床试验
据报道,胎盘是MSCs的另一个有效来源。CB-AC-02(人胎盘 MSCs)静脉移植的安全性和潜在治疗效果将在I/IIa期临床试验(NCT02899091)中进行评估,该试验目前正在招募参与者。这项随机试验将招募24名可能患有AD、淀粉样蛋白配体正电子发射断层扫描 (PET) 呈阳性淀粉样蛋白以及MRI或PET扫描影像学发现的患者。
脂肪干细胞在治疗阿尔茨海默病的临床试验
脂肪衍生的SCs (ADSCs) 已被广泛研究,因为脂肪组织取材方便。
临床前证据已转化为几项正在进行的临床试验(表3)。
表3:脂肪间充质干细胞治疗阿尔茨海默病患者的临床试验
| 干涉 | 剂量[n]/途径 | 临床阶段 | 数量/条件 | 地位 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| ADSVF | 3.5–20cm3SVF,每次注射4.05×105–6.2×107个细胞/cm3/ICV,AD患者输注1–8次 | 第一阶段 | 31/多种神经系统疾病,公元 10年 | 完全的 | 轻微副作用(头痛、切口痛);8例患者病情稳定或好转;3名患者的脑脊液生物标志物减少 | ( 96 ) |
| ADSVF | 路线取决于患者状况 | 不适用/ NCT01953523 | 3,000/多种健康状况;>16岁 | 完全的 | 不适用 | ( 97 ) |
| 自体ADSC (AstroStem) | (I) 自体ADSC[11]/IV,注射9次; (II) 安慰剂(含30%自体血清的生理盐水)[10]/IV,注射9次 | 一期、二期/NCT03117738 | 21/可能公元;>50岁;最小均方误差 16–26 | 完全的 | 没有不良事件报告;ADAS-Cog变化:Astrostem +5.9±6.8安慰剂 +3.0±5.4;MMSE 变化:Astrostem -3.4±2.8安慰剂 -1.4±2.8 | ( 98 ) |
| 自体ADSC (AstroStem) | (I) 2个注射器,装有2.0×108个细胞/20mL盐水和30%自体血清和多奈哌齐安慰剂/IV,注射4次;(II) 5mg多奈哌齐和 Astrostem安慰剂/IV,4 次注射 | IIb期/NCT04482413 | 80/可能轻度 AD;>50岁;MMSE20-24;自诊断以来未服用AD药物;ADCSF生物标志物阳性 | 尚未招募 | 不适用 | ( 99 ) |
| ADSC (HB-adMSC) | 2.0×108个细胞/IV,注射4次 | I期、IIa期/NCT04228666 | 不适用 | 因新冠肺炎而撤回 | 不适用 | ( 100 ) |
| 自体微血管干/基质细胞 | 静脉注射路线 | 不适用/ NCT03297177 | 300/多种神经系统疾病;18-90岁;诊断后6个月;目前的药物治疗失败 | 尚未招募 | 不适用 | ( 101 ) |
| 自体ADSC | 2.0×108个细胞/IV,注射4次 | NA/JPRN-jRCTb030190214 | 32/可能有轻度至中度AD;65-85岁;MMSE提示AD | 暂停 | 不适用 | ( 102 ) |
| 脂肪干细胞 | 不适用 | 不适用/ NCT04855955 | AD晚期,伴有严重认知障碍;目前的药物治疗失败 | 可用的 | 不适用 | ( 103 ) |
| 间充质干细胞外泌体 | (一)低剂量:5μg/鼻滴,每周2次,持续12周;(II)中剂量:10μg/鼻滴,每周2次,持续12周;(III)高剂量:20μg/鼻滴,每周2次,持续12周 | I、II期/ NCT04388982和ChiCTR2000032579 | 9/轻度或中度AD;>50岁;MMSE10-24;改良Hachinski 缺血评分<4;暂停服用认知增强药物 | 招聘 | 不适用 | ( 104 , 105 ) |
骨髓间充质干细胞和造血干细胞治疗阿尔茨海默病患者的临床试验
这些令人鼓舞的临床前结果导致了许多临床试验的发展(表4)。
| 干涉 | 剂量[n]/途径 | 临床阶段 | 数量/条件 | 地位 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| Longeveron 同种异体 hMSC | (一)低剂量:2×107个细胞[10]/IV,注射1次;(II)高剂量:1×108个细胞[10]/IV,注射1次;(III) 安慰剂(Plasmalyte A 和1%人血清白蛋白)[5]/IV,1次注射 | 一期/ NCT02600130 | 33/AD诊断;50-80岁;MMSE 18-24;MRI、淀粉样蛋白 PET 结果呈阳性 | 主动,不招聘 | 不适用 | ( 117 ) |
| 同种异体 hMSC | (I) hMSC 和乳酸林格氏液/IV,注射 1 次;(II) 安慰剂(乳酸林格氏液)/IV,1 次注射 | IIa期/ NCT02833792 | 40/轻度至中度AD;55-80岁;MMSE 12-24;淀粉样蛋白阳性的氟倍吡酯 PET | 招聘 | 不适用 | ( 118 ) |
| 骨髓间充质干细胞 | (I) 第 1 组:14 cc/IV,1 次注射;(II) 第 2 臂:14 cc 和近红外光/IV,1 次注射;(III) 第 3 组:14 cc 和 1 cc 鼻内/IV,1 次注射 | 不适用/ NCT03724136 | 100/AD 或自闭症谱系障碍;>18岁 | 招聘 | 不适用 | ( 119 ) |
| 自体MSC-NTF细胞 | 1.0–1.23×10 8细胞/IT,3次给药 | IIa 期/EUCTR2020-002872-11-NL | 40/前驱期至轻度 AD;50-75岁;MMSE20–30;脑脊液 AD 生物标志物阳性(Aβ42、p-tau) | 招聘可能正在进行或已经结束 | 不适用 | ( 120 ) |
| 非格司亭 (G-CSF) | (I) 10mg/kg/SC,注射5次;(II) 安慰剂(D5W或5%葡萄糖溶液)/SC,注射5次 | 一期、二期/ NCT01617577 | 8/可能AD;>55岁;最小均方误差10–24 | 完全的 | ADAS-Cog评分:治疗后22.25;预处理21.5。PAL(总试验调整)评分:治疗后33.87;预处理28.48。PALmem评分:治疗后5.50;预处理 2.75 | ( 121 ) |
| 非格司亭 (G-CSF) | (I)10mg/kg/SC,连续5天,休息11周;每12周重复给药方案2次;(二)不治疗 | 二期/ NCT03656042 | 21/AD诊断;50-85岁;MMSE 12-26;CDR 1-2;改良 Hachinski 缺血评分 4;汉密尔顿抑郁症精神病评定量表 12 | 完全的 | 不适用 | ( 122 ) |
结论和未来展望
阿尔茨海默病是一种进行性神经退行性疾病,由于干细胞具有独特的再生能力,它们可能是一种有效的治疗选择。尽管干细胞技术取得了进步,通过鼓励在AD动物模型中临床前利用干细胞得到证实,但评估干细胞治疗疗效的临床试验数量有限,许多正在进行的干细胞治疗阿尔茨海默病的临床试验的结果仍悬而未决。这主要是由于尚未克服的限制,包括技术考虑因素,如时间、剂量和细胞移植的适当程序,这些都没有明确确定。与任何其他器官移植一样,干细胞疗法的缺点之一是需要免疫抑制。
未来的工作需要解决这些问题。未来需要评估不同来源、类型、干细胞剂量、长期安全性、有效性和精确作用机制的临床前试验。
众多试验结果表明干细胞治疗阿尔兹海默病时不仅能够调节脑内炎症性环境,而且促进神经再生和突触连接,可以有效改善病症,提高患者生活质量,为更多老年人带来福音。
参考资料:Karvelas N, Bennett S, Politis G, Kouris NI, Kole C. Advances in stem cell therapy in Alzheimer’s disease: a comprehensive clinical trial review. Stem Cell Investig. 2022 Feb 21;9:2. doi: 10.21037/sci-2021-063. PMID: 35280344; PMCID: PMC8898169.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信