近年来,随着干细胞技术在糖尿病治疗领域的不断突破,越来越多2型糖尿病患者实现了摆脱胰岛素依赖,血糖恢复至正常水平的案例不断涌现。这些令人振奋的成果,为长期受糖尿病困扰的患者带来了新的希望。
干细胞疗法的出现,标志着糖尿病治疗正在从单纯“控制症状”迈向“修复病因”的全新时代,为2型糖尿病的治疗展现出前所未有的前景。
本文将基于最新高影响力的临床研究,系统梳理干细胞治疗2型糖尿病的科学机制、研究进展及临床应用等方面的前景,带您全面了解这一创新疗法的潜力。

干细胞治疗2型糖尿病的前景:从临床突破看治愈希望
一、治疗新策略,干细胞攻克2型糖尿病的三重作用
干细胞疗法之所以被认为是糖尿病治疗的革命性突破,源于其作用于疾病根本病理机制的能力。与传统降糖药物和胰岛素替代疗法不同,干细胞瞄准的是2型糖尿病的核心问题——胰岛β细胞功能衰竭和胰岛素抵抗。
1.分化与修复是干细胞最直接的作用方式。多项研究表明,干细胞在特定条件下能够分化为功能性的胰岛β细胞,直接替代患者体内受损或凋亡的β细胞,从根源上增加胰岛素分泌。
更为重要的是,这些再生的β细胞能够对血糖变化做出生理性反应,精准释放适量胰岛素,大大降低了传统胰岛素治疗中常见的低血糖风险。
2.免疫调节与抗炎作用构成了第二重机制。2型糖尿病长期被视为一种慢性炎症性疾病,胰腺和胰岛素靶向组织中存在大量炎症细胞浸润和炎症因子释放。
以间充质干细胞为代表的干细胞类型,能通过调节T细胞、抑制巨噬细胞活化、降低肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)等关键炎症因子的释放,显著减轻胰岛的炎症环境。
3.改善外周胰岛素抵抗是干细胞疗法的第三重机制。干细胞通过归巢效应,定向迁移至脂肪、肝脏和肌肉等胰岛素抵抗的主要部位,通过旁分泌机制释放一系列生物活性因子。
这些因子能够改善靶组织细胞的胰岛素信号转导能力,从外周优化血糖调控,实现血糖水平的稳定。
值得注意的是,近日,发表于《自然》杂志子刊的研究还揭示了干细胞的血管保护功能。科学家发现,干细胞通过分泌STC1蛋白,能有效保护血管内皮细胞,抑制高糖环境下线粒体的过度分裂,从而延缓或改善糖尿病血管并发症。
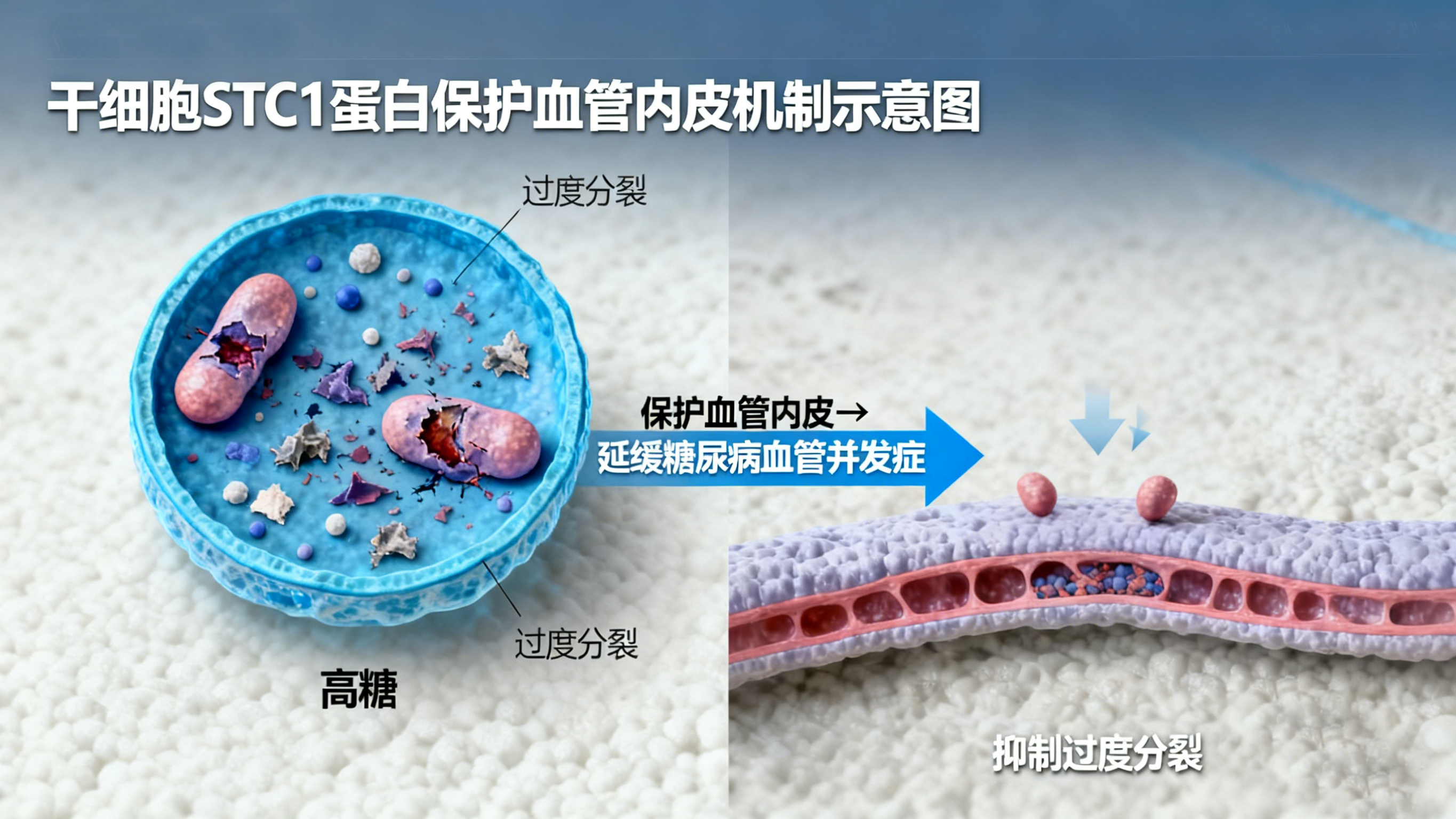
二、临床应用全景,多种策略展现治疗潜力
近年来,随着基础研究的深入,干细胞治疗2型糖尿病的临床转化研究呈现出多元化发展态势,不同细胞类型和治疗策略各展所长。
01.间充质干细胞(MSC)
间充质干细胞因其来源广泛、免疫原性低和伦理争议少而成为当前临床研究的主力军。脐带、脂肪和骨髓来源的MSCs在多项临床试验中显示出稳定疗效。
2025年7月26日,西哈萨克斯坦医科大学牵头在《世界干细胞杂志》上发表了一篇名为《自体和异体间充质干细胞治疗糖尿病:系统评价和荟萃分析》的研究成果。[1]
本系统综述分析了2000年至2025年间发表的研究,重点关注自体和异体MSC治疗2型糖尿病的安全性、有效性和治疗潜力。

研究表明:
血糖控制改善:多项研究显示,MSC疗法可显著降低糖化血红蛋白(HbA1c)和空腹血糖(FBG)。自体MSC移植能够同时改善HbA1c、FBG及胰岛素需求量,而异体MSC移植主要降低FBG和胰岛素需求,但对HbA1c的改善相对有限。这表明MSC疗法在血糖控制方面具有明确的疗效。
胰岛功能恢复:MSC治疗可轻度提升C肽水平,提示β细胞功能得到改善。干细胞通过分化为β细胞或释放旁分泌因子增强胰岛素分泌,使血糖调控更接近生理状态,从根本上改善胰岛功能。
减少药物依赖:临床研究显示,接受MSC治疗的患者胰岛素或口服降糖药需求量普遍下降。部分病程较短的患者在治疗后甚至可以逐步停用胰岛素,实现药物依赖的明显降低。
长期疗效与血糖稳定:MSC疗法能够维持血糖控制的持续性,并在一定程度上保持β细胞功能的稳定。虽然个别指标(如HbA1c)可能随时间出现轻微波动,但总体呈改善趋势,显示出长期疗效的潜力。
辅助改善并发症与代谢环境:MSC治疗还能改善糖尿病相关的代谢环境和并发症。干细胞可降低炎症水平、改善免疫功能,保护肾脏健康,促进伤口愈合,同时减少慢性缺血性伤口截肢风险。通过调节先天与适应性免疫,MSC还能抑制自体免疫攻击β细胞,从而延缓糖尿病并发症的发展。
安全性:多项研究表明,MSC疗法总体安全,无严重或致命副作用。少数患者可能出现轻微的短暂血栓或局部反应,但均可控,显示出良好的临床安全性。
总结一句话:MSC干细胞疗法可有效改善糖尿病患者血糖控制、增强胰岛功能、降低药物依赖,并具有长期稳定性及改善并发症的潜力,同时安全性良好。

02.诱导多能干细胞
诱导多能干细胞代表了糖尿病干细胞治疗研究的另一个重要方向。与间充质干细胞相比,iPSCs具有更强的多能性,能够在体外高效分化为功能性胰岛β细胞,甚至形成结构完整的胰岛群体,从而更接近人体生理状态的血糖调控。
在这一领域,北京大学邓宏魁团队以及上海长征医院殷浩教授团队取得了突破性进展,各自开发了两种创新的技术路线。
北京大学邓宏魁团队路线:
该团队利用人多能干细胞高效诱导分化为功能成熟的胰岛细胞。在实验室中,这些胰岛细胞包含完整的五种内分泌细胞类型(α、β、δ、PP和ε细胞),形成与天然胰岛类似的微结构。
这种完整的细胞组成不仅能够分泌胰岛素,还能在低血糖情况下自动减少胰岛素分泌并增加胰高血糖素释放,实现对血糖变化的智能生理响应,为2型糖尿病患者提供精准血糖调控的可能。
在临床上,该成果在国际上首次报道了利用化学重编程诱导多能干细胞制备的胰岛细胞移植治疗1型糖尿病。首位患者在移植后恢复了内源自主性、生理性的血糖调控,移植75天后完全稳定地脱离胰岛素注射治疗,目前疗效已稳定持续1年以上。实现了1型糖尿病的临床功能性治愈。[2]
上海长征医院殷浩教授团队路线(E‑islet 01):
殷浩团队通过自体干细胞再生胰岛移植技术,将患者自身的细胞重编程为诱导多能干细胞(iPSCs),再进一步诱导分化为内胚层干细胞(EnSC),最后在体外构建功能性再生胰岛(E‑islet)。
这种方法充分利用自体细胞优势,免疫排斥风险低,同时通过在体外形成成熟胰岛群体,实现了对血糖的精准生理性调控,为实现“自体再生胰岛移植”提供了可行路径。
在临床上,该团队通过自体干细胞再生胰岛移植,成功治愈一名患病25年的糖尿病患者。[3]
该患者为59岁男性,患糖尿病25年。接受干细胞疗法后,随访116周内胰岛素需求逐渐减少,并在第11周完全停用。口服降糖药也逐步减量,第48周(阿卡波糖)和第56周(二甲双胍)完全停用。术后平均空腹C肽水平升至术前的3倍(0.68 nmol/L),混合餐耐量试验(MMTT)显示C肽和胰岛素分泌显著增加,AUC分析进一步证实了胰岛功能明显改善。
03.基因工程改造
基因工程改造为干细胞疗法增添了更为精准的“武器”。今年7月,上海瑞金医院与吉源生物合作研发的“GLP-1和FGF21双因子高表达脂肪干细胞注射液”正式启动I期临床试验。[4]
这款创新产品通过基因编辑技术,使干细胞能够持续分泌GLP-1和FGF21这两种关键的代谢调节因子,同时促进胰岛素分泌并改善胰岛素抵抗,实现了“细胞+基因”的双重治疗效应。
04.细胞联合治疗
细胞联合治疗策略则在长期疗效方面展现出独特优势。一项长达8年的随访研究显示,接受骨髓MSCs与单核细胞联合治疗的2型糖尿病患者,不仅血糖控制得到显著改善,糖尿病微血管并发症的发生率更从对照组的48.3%大幅降低至10.3%。[5]
这种不同功能细胞的协同作用——MSCs改善局部微环境,MCs促进组织修复与再生——为预防和治疗糖尿病并发症提供了新思路。
三、2025干细胞治疗的优势
修复性治疗
干细胞疗法不再仅仅是临时控制血糖,它有望真正修复受损的胰岛β细胞。通过分化、旁分泌或免疫调节作用,这些细胞可以恢复胰岛结构与分泌功能,从根本上改善胰岛素分泌能力。与传统药物相比,这种“修复式”治疗是其最大的变革性优势。
减少药物依赖
多种临床和随访研究表明,干细胞治疗后,患者对胰岛素或口服降糖药的需求显著下降。部分早期治疗者甚至实现药物停用或大幅减量。长期来看,这意味着生活质量的提高、注射依赖减少,同时可能降低与胰岛素相关的低血糖风险。
并发症预防与风险降低
干细胞不仅能改善血糖,还能通过调节免疫、抑制炎症、分泌具有血管保护作用的因子 (如 STC1) 等机制,减少糖尿病微血管和大血管并发症。这在长期研究 (例如MSC+单核细胞联合治疗随访8年) 中已有明显体现。
长期稳定性与安全性
尤其是联合MSC+单核细胞治疗,在8年随访期内表现出较好的代谢控制、并发症降低,并且未出现严重长期不良反应。
精准治疗与个性化潜力
- 利用 iPSC 技术 (例如自体再生胰岛),实现患者自身细胞的再生移植,免疫兼容性高。
- 基因工程改造干细胞 (如 GLP‑1 / FGF21 高表达 MSC) 更能针对代谢紊乱机制进行精准干预。
- 细胞联合策略 (不同类型细胞协同) 提供新的治疗思路,可根据患者病情 (并发症、病程等) 个性化设计方案。
四、干细胞技术的未来趋势
更成熟、更安全的分化技术
未来,iPSC向胰岛细胞 (甚至完整胰岛结构) 的分化效率与稳定性将进一步优化。特别是减少肿瘤风险 (如未分化细胞残留)、提高功能成熟度 (胰岛素分泌、葡萄糖响应性) 是关键。
基因工程细胞疗法的发展
基因修饰MSC或iPSC,将代谢调控因子 (如GLP‑1、FGF21、其他细胞因子) 编入细胞中,使它们持续分泌治疗性分子。这种 “细胞+因子” 治疗模式有望成为未来主流。
联合细胞治疗策略
不同功能细胞 (如 MSC、单核细胞、免疫细胞等) 的协同应用将在长期疗效和并发症预防方面发挥更大潜力。未来或出现“混合细胞制剂”或 “组合移植方案”,针对不同患者设计最优细胞组合。
临床规范化与标准化
- 细胞生产 (GMP)、规范化质量控制 (细胞表型、活性、纯度等) 将越来越标准。
- 临床试验 (I / II / III 期) 将逐步扩大,尤其是基因工程和 iPSC 方案,需要更多长期随访数据。
- 安全性监控 (肿瘤形成、异位增殖、免疫反应) 将成为监管重点。
个性化再生医学
随着技术进步,基于患者自身 (自体) 细胞的再生治疗将更普及。未来可能出现 “干细胞治疗 + 基因编辑 + 生物标志物监测” 集成平台,实现真正意义上的个性化糖尿病再生治疗。
结语
干细胞治疗为2型糖尿病打开了一个全新的治疗维度——从控制症状到修复根本。无论是MSC、iPSC还是基因工程修饰细胞,它们都在科学机制和临床应用上展现出前所未有的潜力。尤其是联合细胞治疗、基因工程策略等创新技术,正在推动这一领域迈入更精准、更长期、更安全的新阶段。
然而,尽管临床数据令人振奋,仍需更多大规模、长期 (尤其是5–10年以上) 的研究,以及严格的质量标准和安全监管,才能真正将干细胞疗法推广为临床标准。
可以预见,不久之后,干细胞疗法将不再是“研究热点”,而真正成为2型糖尿病治疗的重要组成部分,为无数患者带来实质性、持久性的健康改善。
参考资料:
[1]Aringazina RA、Zare A、Mousavi SM、Abenova N、Mussin NM、Tamadon A. 自体和异体间充质干细胞治疗糖尿病:系统评价和荟萃分析。 世界干细胞杂志 2025; 17(7): 108202 [PMID: 40740540 DOI: 10.4252/wjsc.v17.i7.108202 ]
[2]Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patientWang, Shusen et al.Cell, Volume 187, Issue 22, 6152 – 6164.e18
[3]Wu, J., Li, T., Guo, M. et al. Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue. Cell Discov 10, 45 (2024). https://doi.org/10.1038/s41421-024-00662-3
[4]https://www.portonbio.com/ndetail/116.html?utm_source=chatgpt.com
[5]Wu, Z., Huang, S., Li, S. et al. Bone marrow mesenchymal stem cell and mononuclear cell combination therapy in patients with type 2 diabetes mellitus: a randomized controlled study with 8-year follow-up. Stem Cell Res Ther 15, 339 (2024). https://doi.org/10.1186/s13287-024-03907-w
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信