2024年12月27日,由澳大利亚伍伦贡大学联合马来西亚吉隆坡IMU大学干细胞研究中心在国际期刊《Biomedicines》上发表了一篇名为《干细胞疗法治疗肌萎缩侧索硬化症:间充质干细胞、神经干细胞和诱导多能干细胞疗效的比较》的研究成果。
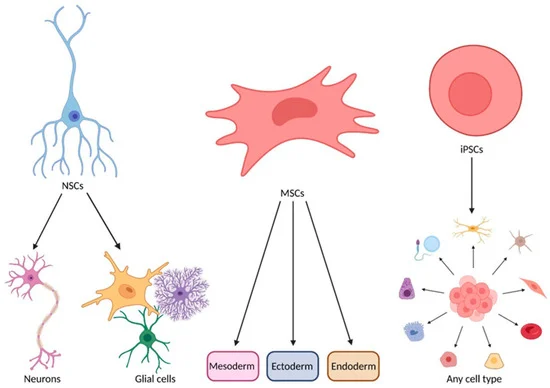
研究评估了间充质干细胞(MSCs)、神经干细胞(NSCs)和诱导多能干细胞(iPSCs)三种干细胞类型在渐冻症(ALS)治疗中的疗效,为探索更有效的ALS干预手段提供了新思路。

干细胞疗法治疗渐冻症:间充质、诱导多能与神经干细胞哪种效果更好?如何选择?
一、为何渐冻症始终难以治疗?
渐冻症(ALS)是一种以运动神经元进行性退变为特征的致命性神经系统疾病。随着运动神经元不断死亡,患者将逐渐丧失运动、言语、吞咽及呼吸功能。
目前获批的药物虽能在一定程度上延缓疾病进程,但无法阻止神经元的持续损伤,更难以修复已受损的神经结构。正因如此,具备“神经保护、损伤修复乃至细胞替代”潜能的干细胞疗法,已成为该领域备受关注的研究焦点。
二、三种干细胞,三条不同的治疗路径
干细胞因具备自我更新、多向分化以及分泌调节等生物学特性,为渐冻症(ALS)的治疗提供了多种潜在干预思路。目前,在相关研究中受到重点关注的主要有三类干细胞,它们在治疗策略和作用重点上各不相同:
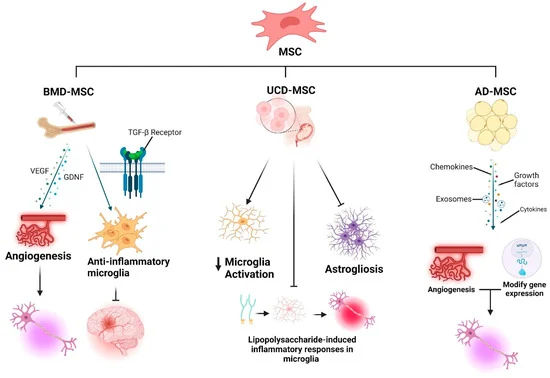
1. 间充质干细胞(MSCs):间充质干细胞主要通过分泌多种活性因子发挥作用,具有抗炎、免疫调节和神经保护等效应。其核心优势在于改善神经微环境、减轻继发性损伤,从而为残存运动神经元提供相对有利的生存条件。
2. 神经干细胞(NSCs):神经干细胞来源于中枢神经系统本身,具备分化为神经元和神经胶质细胞的能力。相较其他类型干细胞,NSCs在理论上更接近“直接替代受损运动神经元”的治疗思路,因此被认为是更具针对性的干预手段。
3. 诱导多能干细胞(iPSCs):诱导多能干细胞具有高度分化潜能,理论上可生成多种神经相关细胞类型,兼具细胞替代和环境支持的双重作用。但受制于制备复杂度、成本及安全性评估等因素,目前仍主要停留在实验研究和早期探索阶段。
尽管这些研究不断推进,但目前对于哪种干细胞在治疗渐冻症中效果更优、更实用,仍存在不同看法。
那么,哪一种策略更有前景?接下来,我们将深入剖析这三类干细胞的临床应用现状。
三、间充质干细胞(MSCs):临床经验最丰富的支持性疗法
间充质干细胞是当前渐冻症干细胞治疗中研究最深入、临床应用经验最丰富的一类。它们主要起“支持与保护”作用,通过分泌多种活性物质,为受损的神经细胞创造生存和修复的环境。
机制层面,间充质干细胞主要是通过分泌血管内皮生长因子(VEGF)和胶质细胞源性神经营养因子(GDNF),促进血管生成并支持运动神经元存活;同时释放TGF-β,促使小胶质细胞由促炎状态转向抗炎状态,从而减轻神经炎症、维持中枢神经系统稳态。
其整体作用更偏向于“改善病理环境、保护残存神经元”,而非直接替代神经元。
临床研究方面:
目前研究主要聚焦于三种来源的间充质干细胞,各有优势:
- 骨髓来源(BM-MSCs):研究最久,临床数据相对较多。可通过腰穿(鞘内注射)回输,在临床研究中显示出减缓疾病进展、可能延长生存期的潜力。但效果存在个体差异,且细胞活性会随供者年龄增长而下降。
- 脂肪来源(AD-MSCs):易于获取、数量丰富。其核心治疗物质“分泌组”(尤其是其中的外泌体)在动物实验中能有效改善运动功能、保护神经接头。鼻内给药等新途径也显示出精准靶向的潜力,但人体疗效尚需严格验证。
- 脐带来源(UC-MSCs):细胞年轻、增殖能力强。其培养液或经基因改造后(如过表达BDNF)的细胞,在动物模型中能显著延长寿命、减轻炎症。早期回顾性临床分析提示其可能有助延长患者生存时间,前景广阔。
下表汇总了目前几项具有代表性的间充质干细胞治疗渐冻症的人体临床试验结果。
| 研究阶段 | 入组人数 | 给药方式 | 给药方案 | 主要研究结果 |
|---|---|---|---|---|
| I期 | 15人 | 鞘内注射(腰椎) | 每3个月1次,共3次 | 病情进展较快患者进展速度减缓;进展较慢患者变化不明显 |
| I/II期 | 157人 | 鞘内注射 | 2次注射,或多次加强注射(3–10次) | 治疗组生存率更高、死亡风险更低;多次注射效果优于少次;一年内未见严重不良反应 |
| I/IIa期 | 20人 | 静脉输注 | 2×10⁶ 个细胞/kg | 出现个别严重不良事件;5名患者在5年随访中仍存活 |
| III期 | 196人 | 鞘内注射 | 共3次给药 | 总体安全性可控;脑脊液中炎症和神经退行相关指标改善 |
| III期(进行中) | 约115人 | 腰椎穿刺(L2–L4) | 按体重给药,共5次 | 尚未公布结果;预计2026年完成,随后进行长期随访 |
四、神经干细胞(NSCs):更贴近疾病本质的修复策略
神经干细胞(NSCs)被寄予厚望,其核心治疗思路是“直接替换”:将具有分化潜能的干细胞移植到患者体内,以期直接生长为新的、健康的运动神经元,替代那些已经损坏的细胞,从而从根源上尝试修复神经功能。
作用机制方面,NSCs更偏向于“结构性修复”。
- 一方面,它们可在脊髓微环境中存活并分化为支持性神经胶质细胞,分泌多种神经营养因子,为运动神经元提供局部保护;
- 另一方面,部分研究显示,NSCs能够在脊髓节段内有限迁移,与周围神经组织建立联系,从而延缓神经元退变。
这种作用模式更接近“补充与替代受损细胞”,而不仅是改善炎症或代谢环境。
临床研究方面:
NSCs的探索起步较早,重点集中在安全性和可行性。多项I期临床试验采用脊髓内注射hNSCs,随访时间最长达5年,结果显示总体耐受性良好,未发现明显的长期并发症或医源性神经损伤。在部分患者中,观察到运动功能稳定或轻度改善。
此外为弥补NSCs自身分泌能力和作用范围有限的问题,基因修饰神经祖细胞成为新的研究方向。
例如,工程化表达胶质细胞源性神经营养因子(GDNF)的NSC衍生细胞,在临床研究中表现出良好的安全性,并在尸检中证实可长期存活并持续分泌神经营养因子,患者出现疾病进展减缓的迹象。
下面表格是几项关键神经干细胞治疗渐冻症人体临床试验的总结。
| 研究阶段 | 入组人数 | 给药方式 | 主要结论 |
|---|---|---|---|
| I 期 | 12 人 | 腰段脊髓内注射(单侧或双侧) | 未发现长期严重并发症;患者疾病进展放缓 |
| I 期 | 18 人 | 脊髓灰质内微量注射(腰段/颈段) | 随访最长5年安全性良好;部分患者进展减缓 |
| II 期 | 15 人 | 颈段±腰段双侧注射,剂量递增 | 未加速疾病进展;ALSFRS-R和生存评分改善 |
| I/IIa 期 | 18 人 | 腰段脊髓内单侧注射 | 随访3–4年未见运动功能恶化;安全性可接受 |
五、诱导多能干细胞(iPSCs):潜力巨大但仍处探索阶段
诱导多能干细胞(iPSCs)的核心治疗思路是“个体化再生替代”。它来源于患者自身的体细胞,经重编程后获得多向分化能力,理论上可分化为运动神经元及多种胶质细胞,用于补充 ALS中不断丢失的神经细胞,从源头尝试修复神经功能。
在作用机制上,iPSCs兼具“直接替代+环境支持”双重作用。
- 一方面,iPSC衍生的运动神经元在动物模型中可形成神经肌肉接头,改善轴突再生和神经传导;
- 另一方面,这些细胞还能分泌神经营养因子和抗炎因子,改善神经微环境,支持残存神经元存活,延缓疾病进展。
在研究与临床进展方面:目前iPSC在ALS中仍以临床前研究和早期探索为主。
动物实验结果较为积极,显示出神经保护和功能改善潜力;但人体研究样本量有限,疗效仍需更多临床试验验证。同时,制备成本高、工艺复杂及基因安全性问题,是其进一步临床转化的主要限制。
六、这三种干细胞,哪一种治疗渐冻症的效果最好?
简单来说,如果在这三种干细胞疗法中做一个更有针对性的选择,神经干细胞更值得重点关注。
原因在于,渐冻症的本质是运动神经元不断死亡。神经干细胞本身就属于中枢神经系统细胞,能够分化为神经元和神经胶质细胞,有机会直接参与修复受损的神经结构,作用更“对症”。
相比之下,间充质干细胞主要是抗炎和保护现有神经元,更像“托底治疗”,对已经发生明显神经元丢失的患者修复能力有限;诱导多能干细胞潜力很大,但目前仍以实验研究为主,距离成熟临床应用还有距离。
因此,在现阶段,从机制匹配度、临床可行性和实际修复潜力综合考虑,神经干细胞是三者中效果更有希望、也更值得推荐的一类。
七、渐冻症患者该如何选择?
对于渐冻症患者及家属而言,面对不断出现的干细胞新研究,最关心的问题往往不是“哪种技术最先进”,而是哪一种更安全、更现实、更适合当下阶段的自己。
从现有证据来看,可以从以下几个方面进行综合考虑:
第一,安全性始终是首要前提
优先关注已有较长随访时间、在多项临床研究中未出现严重安全隐患的治疗路径。
例如,神经干细胞和间充质干细胞在临床试验中总体耐受性较好,而iPSCs目前仍主要停留在实验研究阶段,安全性和稳定性尚需更多验证。
第二,治疗机制是否“对症”
渐冻症的核心问题是运动神经元持续死亡。
从机制匹配度看,神经干细胞具备向神经元和神经胶质细胞分化的能力,有机会直接参与神经结构修复,更贴近疾病本质;
而间充质干细胞更适合作为辅助性支持治疗,用于改善炎症环境、延缓进展。
第三,疾病阶段和个体差异
在疾病早期或进展较快阶段,保护残存神经元、减缓恶化速度尤为重要;而在神经元大量丢失后,是否具备“替代和重建”潜力则更值得关注。
这意味着,不同阶段的患者,适合的治疗策略并不完全相同。
第四,务必选择合规、可追溯的医疗机构
干细胞治疗涉及细胞来源、制备工艺、给药方式和长期随访,必须在具备相应资质的医疗或科研机构中进行。
结语
总体来看,这项系统比较研究为干细胞治疗渐冻症提供了更清晰的认知框架。间充质干细胞在安全性和抗炎保护方面已积累较多经验,诱导多能干细胞代表着未来个体化再生医学的方向,而神经干细胞则在作用机制上与渐冻症的核心病理最为契合,展现出更直接的修复潜力。
虽然未来,干细胞治疗仍处于持续探索阶段,尚不能替代现有规范治疗。但随着临床试验规模扩大、给药方式和细胞工程技术不断优化,干细胞疗法有望为渐冻症患者带来更切实、可及的治疗选择,也为这一“无药可治”的疾病打开新的希望窗口。
信息来源:
Frawley, L.; Taylor, N.T.; Sivills, O.; McPhillamy, E.; To, T.D.; Wu, Y.; Chin, B.Y.; Wong, C.Y. Stem Cell Therapy for the Treatment of Amyotrophic Lateral Sclerosis: Comparison of the Efficacy of Mesenchymal Stem Cells, Neural Stem Cells, and Induced Pluripotent Stem Cells. Biomedicines 2025, 13, 35. https://doi.org/10.3390/biomedicines13010035
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 扫码添加官方微信
扫码添加官方微信